أفكار مندليف حول بنية الذرة. مندليف
(1834-1907) - عالم روسي عظيم، اشتهر بأعماله في مجالات الكيمياء والفيزياء والجيولوجيا والاقتصاد والأرصاد الجوية. وهو أيضًا مدرس ممتاز ومروج للعلوم، وعضو في عدد من أكاديميات العلوم الأوروبية، وأحد مؤسسي الجمعية الفيزيائية والكيميائية الروسية. وفي عام 1984، اختارت منظمة الأمم المتحدة للتربية والعلم والثقافة (اليونسكو) مندليف أعظم عالم في كل العصور.
بيانات شخصية
D. I. ولد مندليف في مدينة توبولسك السيبيرية عام 1834 في عائلة مدير صالة الألعاب الرياضية إيفان بافلوفيتش مندليف وزوجته ماريا دميترييفنا. لقد كان طفلهم الأخير السابع عشر.
في صالة الألعاب الرياضية، درس ديمتري بشكل سيء للغاية، وكان لديه درجات منخفضة في جميع المواد، وكانت اللاتينية صعبة بشكل خاص بالنسبة له. بعد وفاة والده، انتقلت العائلة إلى سان بطرسبرج.
في العاصمة، دخل ديمتري المعهد التربوي، الذي تخرج منه عام 1855 بميدالية ذهبية. بعد تخرجه من المعهد مباشرة تقريبًا، أصيب مندليف بمرض السل الرئوي. كان تشخيص الأطباء مخيبا للآمال، وذهب على عجل إلى سيمفيروبول، حيث كان الجراح الشهير N. I. يعمل في ذلك الوقت. بيروجوف .
عندما فحص بيروجوف ديمتري، قام بتشخيص متفائل: قال إن المريض سيعيش لفترة طويلة جدا. تبين أن الطبيب العظيم كان على حق - وسرعان ما تعافى مندليف تمامًا. عاد ديمتري إلى العاصمة لمواصلة عمله العلمي، وفي عام 1856 دافع عن أطروحة الماجستير في جامعة سانت بطرسبرغ.
تاريخ العمل
بعد أن أصبح على درجة الماجستير، حصل ديمتري على منصب أستاذ مساعد خاص وبدأ بإلقاء محاضرات حول الكيمياء العضوية. وقد حظيت موهبته كمعلم وعالم بتقدير كبير من قبل قيادته، وفي عام 1859 تم إرساله في رحلة علمية لمدة عامين إلى ألمانيا. بعد عودته إلى روسيا، واصل إلقاء المحاضرات وسرعان ما اكتشف أن الطلاب يفتقرون إلى الكتب المدرسية الجيدة. وهكذا في عام 1861، نشر مندليف نفسه كتابًا مدرسيًا بعنوان "الكيمياء العضوية"، والذي حصل قريبًا على جائزة ديميدوف من أكاديمية سانت بطرسبرغ للعلوم. في عام 1864، تم انتخاب مندليف أستاذًا للكيمياء في المعهد التكنولوجي. وفي العام التالي دافع عن أطروحة الدكتوراه "حول مزيج الكحول مع الماء". وبعد ذلك بعامين، ترأس بالفعل قسم الكيمياء غير العضوية في الجامعة. هنا يبدأ ديمتري إيفانوفيتش في كتابة عمله الرائع - "أساسيات الكيمياء".
وفي عام 1869، نشر جدولًا للعناصر بعنوان "مقالة عن نظام العناصر بناءً على وزنها الذري وتشابهها الكيميائي". قام بتجميع جدوله بناءً على القانون الدوري الذي اكتشفه. خلال حياة ديمتري إيفانوفيتش، أعيد نشر "أساسيات الكيمياء" 8 مرات في روسيا و5 مرات في الخارج، باللغات الإنجليزية والألمانية والفرنسية. في عام 1874، اشتق مندليف المعادلة العامة لحالة الغاز المثالي، بما في ذلك، على وجه الخصوص، اعتماد حالة الغاز على درجة الحرارة، والتي اكتشفها في عام 1834 الفيزيائي بي بي إي كلابيرون (معادلة كلابيرون - مندليف).
كما اقترح مندليف وجود عدد من العناصر غير المعروفة في ذلك الوقت. وتم تأكيد أفكاره، كما هو موثق. تمكن العالم العظيم من التنبؤ بدقة بالخصائص الكيميائية للجاليوم والسكانديوم والجرمانيوم.
في عام 1890، غادر مندليف جامعة سانت بطرسبرغ بسبب صراع مع وزير التعليم، الذي رفض، أثناء الاضطرابات الطلابية، قبول التماس الطالب من مندليف. بعد ترك الجامعة، ديمتري إيفانوفيتش في الفترة 1890-1892. شارك في تطوير البارود الذي لا يدخن. منذ عام 1892، كان ديمتري إيفانوفيتش مندلييف هو العالم والوصي على "مستودع الأوزان والمقاييس المثالية"، والذي تم تحويله في عام 1893، بمبادرة منه، إلى الغرفة الرئيسية للأوزان والمقاييس (الآن معهد أبحاث عموم روسيا المقاييس سميت باسم D. I. Mendeleev). وفي مجاله الجديد، حقق مندليف نتائج جيدة، حيث ابتكر طرق الوزن الأكثر دقة في ذلك الوقت. بالمناسبة، غالبا ما يرتبط اسم Mendeleev باختيار الفودكا بقوة 40 درجة.
طور مندليف تقنية جديدة لتكرير النفط، وشارك في كيميائي الزراعة، وابتكر جهازًا (مقياس البيكنومتر) لتحديد كثافة السوائل. في عام 1903، كان أول لجنة حكومية للقبول في معهد كييف للفنون التطبيقية.
بالإضافة إلى العلوم، كان مندليف على دراية جيدة بالاقتصاد. ذات مرة قال مازحا: "أي نوع من الكيميائي أنا، أنا خبير اقتصادي سياسي. وماذا عن «أساسيات الكيمياء»، أما «التعريفة المعقولة» فأمر آخر». كان هو الذي اقترح نظام التدابير الحمائية لتعزيز اقتصاد الإمبراطورية الروسية. لقد دافع باستمرار عن ضرورة حماية الصناعة الروسية من المنافسة من الدول الغربية، وربط تطوير الصناعة الروسية بالسياسة الجمركية. وأشار العالم إلى ظلم النظام الاقتصادي الذي يسمح للدول التي تقوم بتصنيع المواد الخام بجني ثمار عمل العمال في الدول التي توفر المواد الخام.
كما طور مندليف أساسًا علميًا للطرق الواعدة للتنمية الاقتصادية. قبل وقت قصير من وفاته، في عام 1906، نشر مندليف كتابه "نحو فهم لروسيا"، والذي لخص فيه وجهات نظره حول آفاق تنمية البلاد.
معلومات عن الأقارب
جاء والد ديمتري إيفانوفيتش مندليف، إيفان بافلوفيتش مندليف، من عائلة كاهن ودرس هو نفسه في مدرسة لاهوتية.
الأم - ماريا دميترييفنا، جاءت من عائلة كورنيليف التجارية القديمة ولكن الفقيرة.
اختار ابن ديمتري إيفانوفيتش من زواجه الأول، فلاديمير (1865-1898)، مهنة بحرية. تخرج بمرتبة الشرف من فيلق كاديت البحرية، وأبحر على متن الفرقاطة "ذاكرة آزوف" حول آسيا وعلى طول شواطئ الشرق الأقصى للمحيط الهادئ (1890-1893). كما شارك في دخول السرب الروسي إلى فرنسا. وفي عام 1898، تقاعد وبدأ في تطوير “مشروع رفع مستوى بحر آزوف عن طريق إقامة السدود على مضيق كيرتش”. أظهر عمله بوضوح موهبة المهندس الهيدرولوجي، لكن ابن مندليف لم يكن مقدراً له تحقيق نجاحات علمية كبيرة - فقد توفي فجأة في 19 ديسمبر 1898.
أولغا هي أخت فلاديمير (1868-1950)، تخرجت من المدرسة الثانوية وتزوجت من أليكسي فلاديميروفيتش تريوجوف، الذي درس مع شقيقها في فيلق كاديت البحرية. لقد كرست حياتها الطويلة تقريبًا لعائلتها. كتبت أولجا كتاب مذكرات بعنوان "مندليف وعائلته" والذي نُشر عام 1947.
في زواجه الثاني، أنجب مندليف أربعة أطفال: ليوبوف وإيفان والتوأم ماريا وفاسيلي.
من بين جميع أحفاد ديمتري إيفانوفيتش، تبين أن ليوبا هو الشخص الذي أصبح معروفا لدائرة واسعة من الناس. وقبل كل شيء، ليس كابنة عالم عظيم، ولكن كزوجة الكسندرا بلوك- الشاعر الروسي الشهير في العصر الفضي وبطلة دورته "قصائد لسيدة جميلة".
تخرجت ليوبا من "الدورات النسائية العليا" وكانت مهتمة لبعض الوقت بالفن المسرحي. في 1907-1908 لعبت في فرقة V. E. Meyerhold وفي مسرح V. F. Komissarzhevskaya. كانت الحياة الزوجية لـ Bloks فوضوية وصعبة، وعلى نفس القدر من اللوم على ألكساندر وليوبوف. ومع ذلك، في السنوات الأخيرة من حياة الشاعر، ظلت زوجته دائما إلى جانبه. بالمناسبة، أصبحت أول أداء علني لقصيدة "الاثني عشر". بعد وفاة بلوك، درس ليوبوف تاريخ ونظرية فن الباليه، ودرس في مدرسة أجريبينا فاجانوفا التعليمية وأعطى دروسًا في التمثيل لراقصتي الباليه الشهيرتين غالينا كيريلوفا وناتاليا دودينسكايا. توفي ليوبوف دميترييفنا في عام 1939.
تخرج إيفان دميترييفيتش (1883-1936) من صالة الألعاب الرياضية عام 1901 بميدالية ذهبية، والتحق بمعهد سانت بطرسبرغ للفنون التطبيقية، لكنه سرعان ما انتقل إلى كلية الفيزياء والرياضيات بالجامعة. لقد ساعد والده كثيرًا في إجراء حسابات معقدة لأعماله الاقتصادية. بفضل إيفان، تم نشر الطبعة بعد وفاته من عمل العالم "إضافة إلى معرفة روسيا". بعد وفاة ديمتري إيفانوفيتش، تغيرت حياة ابنه بشكل كبير. عاش في فرنسا لعدة سنوات، ثم استقر في عقار منديليف في بوبلوفو، وقام بتنظيم مدرسة هناك لأطفال الفلاحين.
ومن عام 1924 حتى وفاته، عمل إيفان في “الغرفة الرئيسية للأوزان والمقاييس”، مواصلًا عمل والده الذي نشر عددًا من المؤلفات في مجال نظرية الأوزان والمقاييس. أجرى هنا بحثًا حول نظرية المقاييس وتصميم منظمات الحرارة. لقد كان من أوائل من درسوا خصائص "الماء الثقيل" في اتحاد الجمهوريات الاشتراكية السوفياتية. منذ صغره، درس إيفان الفلسفة. وقد أوجز أفكاره في كتابي "خواطر حول المعرفة" و"تبرير الحقيقة" اللذين نُشرا في الأعوام 1909-1910. بالإضافة إلى ذلك، كتب إيفان مذكرات عن والده. تم نشرها بالكامل فقط في عام 1993. كتب أحد كتاب سيرة العالم، ميخائيل نيكولايفيتش ملادينتسيف، أنه بين الابن والأب "كانت هناك علاقة ودية نادرة. لاحظ ديمتري إيفانوفيتش المواهب الطبيعية لابنه، وكان في شخصه صديقًا ومستشارًا شارك معه الأفكار والأفكار.
تم الحفاظ على القليل من المعلومات حول فاسيلي. ومن المعروف أنه تخرج من المدرسة الفنية البحرية في كرونستادت. كان لديه موهبة الإبداع الفني وقام بتطوير نموذج لدبابة ثقيلة للغاية. بعد الثورة، قاده القدر إلى كوبان، إلى إيكاترينودار، حيث توفي بسبب التيفوس في عام 1922.
درست ماريا في "الدورات الزراعية العليا للنساء" في سانت بطرسبرغ، ثم قامت بالتدريس لفترة طويلة في المدارس الفنية. بعد الحرب الوطنية العظمى، أصبحت رئيسة أرشيف متحف D. I. Mendeleev في جامعة لينينغراد. قبل عام من وفاة ماريا دميترييفنا، تم نشر أول مجموعة من المعلومات الأرشيفية حول منديليف، والتي عملت عليها - "أرشيف دي مينديليف" (1951).
الحياة الشخصية
في عام 1857، تقدم ديمتري مندليف لخطبة صوفيا كاش، التي كان يعرفها في توبولسك، وأعطاها خاتم خطوبة، واستعد جديًا للزواج من الفتاة التي يحبها كثيرًا. لكن بشكل غير متوقع أعادت له صوفيا خاتم الزواج وقالت إنه لن يكون هناك حفل زفاف. لقد صدم مندليف بهذه الأخبار، ومرض ولم يخرج من السرير لفترة طويلة. قررت أخته أولغا إيفانوفنا مساعدة شقيقها في تنظيم حياته الشخصية وأصرت على خطوبته لفيوزفا نيكيتيشنايا ليشيفا (1828-1906)، التي كان مندليف يعرفها في توبولسك. كانت فيوزفا، الابنة بالتبني لمعلم مندليف، الشاعر بيوتر بتروفيتش إرشوف، مؤلف كتاب "الحصان الأحدب الصغير" الشهير، أكبر من العريس بست سنوات. في 29 أبريل 1862 تزوجا.
في هذا الزواج، ولد ثلاثة أطفال: ابنة ماريا (1863) - توفيت في سن الطفولة، ابن فولوديا (1865) وابنة أولغا. أحب Mendeleev الأطفال كثيرا، لكن العلاقة مع زوجته لم تنجح. ولم تفهم مطلقا زوجها الذي كان منشغلا بالبحث العلمي. في كثير من الأحيان كانت هناك صراعات في الأسرة، وكان يشعر بالتعاسة، وهو ما أخبر أصدقاءه عنه. ونتيجة لذلك، انفصلا، على الرغم من أنهما ظلا متزوجين رسميًا.
في عمر 43 عامًا، وقع ديمتري إيفانوفيتش في حب آنا بوبوفا البالغة من العمر 19 عامًا، وهي جميلة كانت تزور منزل مندلييف كثيرًا. كانت مولعة بالرسم، وكانت متعلمة جيدًا، ووجدت بسهولة لغة مشتركة مع المشاهير الذين تجمعوا في ديمتري إيفانوفيتش. بدأوا العلاقة، على الرغم من أن والد آنا كان ضد هذا الاتحاد بشكل قاطع وطالب منديليف بترك ابنته وحدها. لم يوافق ديمتري إيفانوفيتش، ثم تم إرسال آنا إلى الخارج، إلى إيطاليا. ومع ذلك، تبعها ديمتري إيفانوفيتش. وبعد شهر عادا إلى المنزل معًا وتزوجا. تبين أن هذا الزواج كان ناجحًا جدًا. كان الزوجان متوافقين جيدًا ويفهمان بعضهما البعض بشكل مثالي. كانت آنا إيفانوفنا زوجة جيدة ويقظة تعيش في مصلحة زوجها الشهير.
هوايات
أحب ديمتري إيفانوفيتش الرسم والموسيقى وكان مولعا بالخيال وخاصة الروايات جول فيرن. على الرغم من جدول أعماله المزدحم، قام ديمتري إيفانوفيتش بصنع الصناديق وحقائب السفر وإطارات الصور والكتب المجمعة. أخذ مندليف هوايته على محمل الجد، وكانت الأشياء التي صنعها بيديه ذات جودة عالية. هناك قصة حول كيف كان ديمتري إيفانوفيتش يشتري ذات مرة موادًا لمصنوعاته اليدوية، ومن المفترض أن أحد البائعين سأل آخر: "من هو هذا السيد المحترم؟" كانت الإجابة غير متوقعة تمامًا: "أوه، هذا هو سيد الحقائب - مندليف!"
ومن المعروف أيضًا أن مندليف قام بخياطة ملابسه بنفسه، معتبرًا أن الملابس التي تم شراؤها من المتجر غير مريحة.
الأعداء
كان أعداء مندليف الحقيقيون هم أولئك الذين صوتوا ضد انتخابه كأكاديمي. على الرغم من حقيقة أن مندليف قد أوصى بمنصب الأكاديمي من قبل العالم العظيم أ.م. بتليروفوعلى الرغم من حقيقة أن ديمتري إيفانوفيتش كان بالفعل مشهورًا عالميًا ومعترفًا به كزعيم علمي، فقد صوت الأشخاص التاليون ضد انتخابه: ليتكي، فيسيلوفسكي، هيلميرسن، شرينك، ماكسيموفيتش، ستراوخ، شميدت، وايلد، جادولين. ها هي قائمة الأعداء الواضحين للعالم الروسي. وحتى بيلشتاين، الذي أصبح أكاديميًا بدلاً من مندليف بفارق صوت واحد فقط، كان كثيرًا ما يقول: «في روسيا لم يعد لدينا مواهب قوية مثل مندليف». ومع ذلك، لم يتم تصحيح الظلم أبدا.
الصحابة
كان الصديق المقرب وحليف مندليف هو عميد جامعة سانت بطرسبرغ أ.ن. بيكيتوف- جد الكسندر بلوك. كانت عقاراتهم تقع بالقرب من كلين، وليس بعيدا عن بعضها البعض. كما كان زملاء مندليف العلميون أعضاء في أكاديمية سانت بطرسبرغ للعلوم - بونياكوفسكي، وكوكشاروف، وبتلروف، وفامينتسين، وأوفسيانيكوف، وتشيبيشيف، وأليكسييف، وستروف، وسافي. وكان من بين أصدقاء العالم فنانين روس عظماء ريبين , شيشكين , كويندزي .
نقاط الضعف
كان مندليف يدخن كثيرًا، ويختار التبغ بعناية، ويلف سجائره بنفسه، ولم يستخدم أبدًا حامل السجائر. وعندما نصحه الأصدقاء والأطباء بالإقلاع عن التدخين، مشيرين إلى تدهور حالته الصحية، قال إنك قد تموت دون تدخين. نقطة ضعف أخرى لديمتري إيفانوفيتش، إلى جانب التبغ، كانت الشاي. كان لديه قناته الخاصة لتوصيل الشاي إلى المنزل من كياختا، حيث وصل في قوافل من الصين. وافق مندليف عبر "القنوات العلمية" على طلب الشاي لنفسه عبر البريد مباشرة من هذه المدينة إلى منزله مباشرة. لقد طلب ذلك لعدة سنوات مرة واحدة، وعندما تم تسليم tsibiki إلى الشقة، بدأت الأسرة بأكملها في فرز الشاي وتعبئته. كانت الأرضية مغطاة بمفارش المائدة، وتم فتح Cibiks، وتم سكب كل الشاي على مفرش المائدة وخلطه بسرعة. كان لا بد من القيام بذلك لأن الشاي الموجود في السيبيك يوضع في طبقات ويجب خلطه في أسرع وقت ممكن حتى لا يجف. ثم يتم سكب الشاي في زجاجات زجاجية ضخمة وإغلاقها بإحكام. وشارك جميع أفراد الأسرة في الحفل، كما شارك جميع أفراد الأسرة والأقارب الشاي. حصل شاي مندليف على شهرة كبيرة بين معارفه، ولم يشرب ديمتري إيفانوفيتش نفسه، دون التعرف على أي شخص آخر، الشاي عند زيارته.
وفقا لمذكرات العديد من الأشخاص الذين عرفوا العالم العظيم عن كثب، كان شخصا صعبا وقاسيا وغير مقيد. ومن الغريب أنه حتى كونه عالمًا مشهورًا جدًا، كان دائمًا متوترًا عند عرض التجارب، خوفًا من "الوقوع في الإحراج".
نقاط القوة
عمل مندليف في مختلف مجالات العلوم وحقق نتائج ممتازة في كل مكان. حتى عدد قليل من الأرواح البشرية العادية لن تكون كافية لمثل هذا الإنفاق الهائل من الذكاء والقوة الروحية. لكن العالم كان يتمتع بأداء استثنائي وقدرة على التحمل والتفاني بشكل لا يصدق. تمكن من أن يكون متقدمًا بسنوات عديدة على عصره في العديد من مجالات العلوم.
طوال حياته، قدم منديليف تنبؤات وتوقعات مختلفة، والتي تحققت دائمًا تقريبًا، لأنها استندت إلى الذكاء الطبيعي والمعرفة المهمة والحدس الفريد. هناك العديد من شهادات أقاربه وأصدقائه، الذين صدموا من موهبة العالم العبقري في توقع الأحداث، ورؤية المستقبل حرفيًا، ليس فقط في العلوم، ولكن أيضًا في مجالات الحياة الأخرى. كان لدى Mendeleev مهارات تحليلية ممتازة، وتم تأكيد تنبؤاته، حتى فيما يتعلق بالقضايا السياسية، ببراعة. على سبيل المثال، تنبأ بدقة ببداية الحرب الروسية اليابانية عام 1905 والعواقب الوخيمة لهذه الحرب بالنسبة لروسيا.
الطلاب الذين قام بتدريسهم أحبوا أستاذهم اللامع كثيرًا، لكنهم قالوا إنه واجه صعوبة في اجتياز الامتحانات. لم يقدم تنازلات لأي شخص، ولم يتسامح مع الإجابات سيئة الإعداد، ولم يكن متسامحًا مع الطلاب المهملين.
كان مندليف قاسيًا وقاسيًا في الحياة اليومية، ويعامل الأطفال بلطف شديد ويحبهم بحنان لا يصدق.
المزايا والإخفاقات
لقد تم الاعتراف بخدمات مندليف للعلم منذ فترة طويلة من قبل العالم العلمي بأكمله. لقد كان عضوًا في جميع الأكاديميات الأكثر موثوقية التي كانت موجودة في عصره تقريبًا وعضوًا فخريًا في العديد من الجمعيات العلمية (بلغ إجمالي عدد المؤسسات التي اعتبرت مندليف عضوًا فخريًا 100 مؤسسة). حظي اسمه بشرف خاص في إنجلترا، حيث مُنح أوسمة ديفي وفاراداي وكوبليان، حيث تمت دعوته (1888) كمحاضر في فاراداي، وهو شرف لا يحصل عليه إلا عدد قليل من العلماء.
في عام 1876، كان عضوًا مراسلًا في أكاديمية سانت بطرسبرغ للعلوم، وفي عام 1880، تم ترشيحه كأكاديمي، ولكن تم قبول بيلشتاين، مؤلف كتاب مرجعي موسع عن الكيمياء العضوية، بدلاً من ذلك. تسببت هذه الحقيقة في سخط دوائر واسعة من المجتمع الروسي. وبعد سنوات قليلة، عندما طُلب من مندليف مرة أخرى الترشح للأكاديمية، رفض.
مندليف هو بالتأكيد عالم بارز، ولكن حتى أعظم الناس يرتكبون الأخطاء. مثل العديد من العلماء في ذلك الوقت، دافع عن المفهوم الخاطئ لوجود "الأثير" - كيان خاص يملأ الفضاء الكوني وينقل الضوء والحرارة والجاذبية. افترض مندليف أن الأثير يمكن أن يكون حالة معينة من الغازات عند تخلخل عالي أو غاز خاص ذو وزن منخفض جدًا. في عام 1902، تم نشر أحد أعماله الأصلية، "محاولة لفهم كيميائي للأثير العالمي". يعتقد مندليف أن "الأثير العالمي يمكن تصوره مثل الهيليوم والأرجون، غير قادر على المركبات الكيميائية". أي أنه من الناحية الكيميائية اعتبر الأثير عنصرا يسبق الهيدروجين، ولوضعه في جدوله أدخله في المجموعة الصفرية والدورة الصفرية. أظهر المستقبل أن مفهوم مندليف للفهم الكيميائي للأثير تبين أنه خاطئ، مثل كل المفاهيم المماثلة.
ولم يمض وقت طويل قبل أن يتمكن مندليف من فهم أهمية هذه الإنجازات الأساسية مثل اكتشاف ظاهرة النشاط الإشعاعي، والإلكترون، والنتائج اللاحقة المرتبطة مباشرة بهذه الاكتشافات. واشتكى من أن الكيمياء أصبحت "متشابكة مع الأيونات والإلكترونات". فقط بعد زيارة مختبرات كوري وبيكريل في باريس في أبريل 1902، غير مندليف وجهة نظره. بعد مرور بعض الوقت، أصدر تعليماته لأحد مرؤوسيه في بيت الأوزان والمقاييس بإجراء دراسة للظواهر المشعة، والتي، مع ذلك، لم يكن لها أي عواقب بسبب وفاة العالم.
الأدلة المساومة
عندما أراد منديليف إضفاء الطابع الرسمي على علاقته مع آنا بوبوفا، واجه صعوبات كبيرة، لأن الطلاق الرسمي والزواج مرة أخرى كانت عمليات معقدة في تلك السنوات. ولمساعدة الرجل العظيم في ترتيب حياته الشخصية، أقنع أصدقاؤه زوجة مندليف الأولى بالموافقة على الطلاق. ولكن حتى بعد موافقتها والطلاق اللاحق، كان على ديمتري إيفانوفيتش، وفقا لقوانين ذلك الوقت، الانتظار ست سنوات أخرى قبل الدخول في زواج جديد. فرضت عليه الكنيسة "كفارة لمدة ست سنوات". من أجل الحصول على إذن بالزواج الثاني، دون انتظار انتهاء فترة الست سنوات، قام ديمتري إيفانوفيتش برشوة الكاهن. كان مبلغ الرشوة ضخمًا - 10 آلاف روبل، للمقارنة - قدرت ملكية مندليف بـ 8 آلاف.
تم إعداد الملف بواسطة ديونيسوس كابتاري
KM.RU 13 مارس 2008
ديمتري إيفانوفيتش مندليف عالم روسي، كيميائي لامع، فيزيائي، باحث في مجال المقاييس، الهيدروديناميكية، الجيولوجيا، خبير عميق في الصناعة، صانع أدوات، اقتصادي، طيار، مدرس، شخصية عامة ومفكر أصيل.
الطفولة والشباب
ولد العالم العظيم عام 1834، في 8 فبراير، في توبولسك. كان الأب إيفان بافلوفيتش مديرًا لمدارس المنطقة وصالة توبولسك للألعاب الرياضية، وينحدر من عائلة القس بافيل ماكسيموفيتش سوكولوف، روسي الجنسية.
قام إيفان بتغيير اسمه الأخير عندما كان طفلاً عندما كان طالبًا في مدرسة تفير. من المفترض أن هذا تم على شرف عرابه مالك الأرض مندليف. في وقت لاحق، أثيرت مرارا وتكرارا مسألة جنسية لقب العالم. وبحسب بعض المصادر، فقد شهدت على جذور يهودية، وبحسب مصادر أخرى، على جذور ألمانية. قال ديمتري مندليف نفسه إن اسمه الأخير قد خصصه لإيفان من قبل معلمه من المدرسة اللاهوتية. قام الشاب بتبادل ناجح وبالتالي أصبح مشهورا بين زملائه في الفصل. بكلمتين - "للقيام" - تم إدراج إيفان بافلوفيتش في السجل التعليمي.

كانت الأم ماريا دميترييفنا (née Kornilieva) تعمل في تربية الأطفال والتدبير المنزلي، وكانت تتمتع بسمعة طيبة كامرأة ذكية وذكية. كان ديمتري الأصغر في الأسرة، والأخير من بين أربعة عشر طفلاً (وفقًا لمعلومات أخرى، الأخير من بين سبعة عشر طفلاً). في سن العاشرة، فقد الصبي والده، الذي أصبح أعمى وسرعان ما توفي.
أثناء الدراسة في صالة الألعاب الرياضية، لم يظهر ديمتري أي قدرات، وكانت اللاتينية هي الأصعب بالنسبة له. غرست والدته حب العلم، كما شاركت في تكوين شخصيته. أخذت ماريا دميترييفنا ابنها للدراسة في سان بطرسبرج.

في عام 1850، في سانت بطرسبرغ، دخل الشاب المعهد التربوي الرئيسي في قسم العلوم الطبيعية والفيزياء والرياضيات. كان أساتذته أساتذة E. H. Lenz، A. A. Voskresensky و N. V. Ostrogradsky.
أثناء الدراسة في المعهد (1850-1855)، أظهر مندليف قدرات غير عادية. عندما كان طالبًا، نشر مقالًا بعنوان "حول التماثل" وسلسلة من التحليلات الكيميائية.
العلم
في عام 1855، حصل ديمتري على دبلوم بميدالية ذهبية وإحالة إلى سيمفيروبول. هنا يعمل كمدرس كبير في صالة الألعاب الرياضية. مع اندلاع حرب القرم، انتقل مندليف إلى أوديسا وحصل على منصب تدريسي في مدرسة ليسيوم.

في عام 1856 كان مرة أخرى في سان بطرسبرج. يدرس في الجامعة ويدافع عن أطروحته ويدرس الكيمياء. وفي الخريف يدافع عن أطروحة أخرى ويتم تعيينه أستاذاً مساعداً خاصاً في الجامعة.
في عام 1859، تم إرسال مندليف في رحلة عمل إلى ألمانيا. يعمل في جامعة هايدلبرغ، وينشئ مختبراً، ويدرس السوائل الشعرية. وهنا كتب مقالات "عن درجة الغليان المطلق" و"عن تمدد السوائل"، واكتشف ظاهرة "درجة الحرارة الحرجة".

في عام 1861، عاد العالم إلى سانت بطرسبرغ. قام بتأليف كتاب "الكيمياء العضوية"، والذي حصل على جائزة ديميدوف. في عام 1864 كان بالفعل أستاذًا، وبعد ذلك بعامين ترأس القسم، حيث قام بالتدريس والعمل على "أساسيات الكيمياء".
في عام 1869، قدم النظام الدوري للعناصر، الذي كرس حياته كلها لتحسينه. في الجدول، قدم مندليف الكتل الذرية لتسعة عناصر، ثم أضاف لاحقًا مجموعة من الغازات النبيلة إلى الجدول، تاركًا المجال لعناصر لم يتم اكتشافها بعد. وفي التسعينيات، ساهم ديمتري مندليف في اكتشاف ظاهرة النشاط الإشعاعي. وتضمن القانون الدوري أدلة على العلاقة بين خواص العناصر وحجمها الذري. الآن بجانب كل جدول للعناصر الكيميائية توجد صورة للمكتشف.

في 1865-1887 طور نظرية ترطيب المحاليل. وفي عام 1872 بدأ دراسة مرونة الغازات، وبعد ذلك بعامين استنتج معادلة الغاز المثالي. من بين إنجازات مندليف في هذه الفترة كان إنشاء مخطط للتقطير التجزيئي للمنتجات البترولية، واستخدام الخزانات وخطوط الأنابيب. بمساعدة ديمتري إيفانوفيتش، توقف حرق الذهب الأسود في الأفران تماما. لقد أصبحت عبارة العالم "حرق الزيت مثل حرق الموقد بالأوراق النقدية" قولاً مأثورًا.

مجال آخر من أنشطة العالم هو البحث الجغرافي. في عام 1875، حضر ديمتري إيفانوفيتش المؤتمر الجغرافي الدولي في باريس، حيث قدم اختراعه - مقياس الارتفاع التفاضلي. وفي عام 1887، شارك العالم في رحلة بالمنطاد إلى الغلاف الجوي العلوي لمراقبة كسوف كلي للشمس.
في عام 1890، أدى شجار مع مسؤول رفيع المستوى إلى مغادرة مندليف الجامعة. في عام 1892، اخترع الكيميائي طريقة لإنتاج البارود الذي لا يدخن. وفي الوقت نفسه، تم تعيينه حارسًا لمستودع الأوزان والمقاييس المثالية. هنا يقوم بتجديد النماذج الأولية للجنيه والأرشين، ويقوم بإجراء حسابات مقارنة معايير القياس الروسية والإنجليزية.

بمبادرة من مندليف، في عام 1899، تم تقديم النظام المتري للقياسات اختياريًا. في أعوام 1905 و1906 و1907 تم ترشيح العالم لجائزة نوبل. وفي عام 1906، منحت لجنة نوبل الجائزة لمندليف، لكن الأكاديمية الملكية السويدية للعلوم لم تؤكد هذا القرار.
كان مندليف، الذي كان مؤلفًا لأكثر من ألف ونصف عمل، يتمتع بسلطة علمية هائلة في العالم. حصل العالم مقابل خدماته على العديد من الألقاب العلمية والجوائز الروسية والأجنبية، وكان عضوًا فخريًا في عدد من الجمعيات العلمية في الداخل والخارج.
الحياة الشخصية
في شبابه، حدث حادث غير سارة لديمتري. انتهت خطوبته مع الفتاة سونيا التي كان يعرفها منذ الطفولة بالخطوبة. لكن الجمال المدلل لم يصل إلى التاج أبدًا. عشية الزفاف، عندما كانت الاستعدادات على قدم وساق، رفض Sonechka الزواج. اعتقدت الفتاة أنه لا فائدة من تغيير أي شيء إذا كانت الحياة جيدة بالفعل.

كان ديمتري قلقا بشكل مؤلم بشأن الانفصال عن خطيبته، لكن الحياة استمرت كالمعتاد. لقد انصرف عن أفكاره الثقيلة برحلة إلى الخارج وإلقاء محاضرات وأصدقاء مخلصين. بعد تجديد علاقته مع Feozva Nikitichnaya Leshcheva، التي كان يعرفها سابقًا، بدأ في مواعدتها. كانت الفتاة أكبر من ديمتري بـ 6 سنوات، لكنها بدت صغيرة، لذا كان فارق السن غير ملحوظ.

في عام 1862 أصبحا زوجًا وزوجة. ولدت الابنة الأولى ماشا عام 1863، لكنها عاشت بضعة أشهر فقط. في عام 1865، ولد ابن فولوديا، وبعد ثلاث سنوات - ابنة أوليا. كان ديمتري إيفانوفيتش مرتبطًا بالأطفال، لكنه خصص لهم القليل من الوقت، حيث كانت حياته مكرسة للنشاط العلمي. وفي الزواج الذي تم على مبدأ "التحمل والوقوع في الحب"، لم يكن سعيدا.

في عام 1877، التقى ديمتري مع آنا إيفانوفنا بوبوفا، التي أصبحت بالنسبة له شخصًا قادرًا على دعمه بكلمة ذكية في الأوقات الصعبة. تبين أن الفتاة كانت شخصًا موهوبًا بشكل إبداعي: فقد درست البيانو في المعهد الموسيقي ولاحقًا في أكاديمية الفنون.
استضاف ديمتري إيفانوفيتش الشباب "الجمعة"، حيث التقى آنا. وتحولت «أيام الجمعة» إلى «بيئات» أدبية وفنية، يرتادها الفنانون والأساتذة الموهوبون. وكان من بينهم نيكولاي فاغنر ونيكولاي بيكيتوف وآخرين.

تم زواج ديمتري وآنا في عام 1881. وسرعان ما ولدت ابنتهما ليوبا، وظهر الابن إيفان في عام 1883، والتوأم فاسيلي وماريا - في عام 1886. في زواجه الثاني، كانت الحياة الشخصية للعالم سعيدة. في وقت لاحق، أصبح الشاعر صهر ديمتري إيفانوفيتش، بعد أن تزوج من ابنة العالم ليوبوف.
موت
في بداية عام 1907، عقد اجتماع بين ديمتري مندليف ووزير الصناعة الجديد دميتري فيلوسوفوف في غرفة الأوزان والمقاييس. وبعد القيام بجولة في الجناح، أصيب العالم بنزلة برد تسببت في التهاب رئوي. لكن على الرغم من مرضه الشديد، واصل ديمتري العمل على مخطوطة "نحو معرفة روسيا"، وكانت الكلمات الأخيرة التي كتبها هي العبارة:
"في الختام، أرى أنه من الضروري، على الأقل بالعبارات الأكثر عمومية، التعبير عن..."

حدثت الوفاة في الساعة الخامسة صباحًا يوم 2 فبراير بسبب شلل القلب. يقع قبر ديمتري مندليف في مقبرة فولكوف في سانت بطرسبرغ.
تم تخليد ذكرى ديمتري مندليف بعدد من الآثار والأفلام الوثائقية وكتاب “ديمتري مندليف. مؤلف القانون العظيم."
- ترتبط العديد من حقائق السيرة الذاتية المثيرة للاهتمام باسم ديمتري منديليف. بالإضافة إلى أنشطته كعالم، شارك ديمتري إيفانوفيتش في الاستكشاف الصناعي. في السبعينيات، بدأت صناعة النفط في الازدهار في الولايات المتحدة، وظهرت التقنيات التي جعلت إنتاج المنتجات البترولية أرخص. بدأ المصنعون الروس في تكبد خسائر في السوق الدولية بسبب عدم قدرتهم على المنافسة على السعر.
- في عام 1876، بناءً على طلب وزارة المالية الروسية والجمعية الفنية الروسية، التي تعاونت مع الإدارة العسكرية، ذهب مندليف إلى الخارج لحضور معرض للابتكارات التقنية. وفي الموقع، تعلم الكيميائي مبادئ مبتكرة لصنع الكيروسين والمنتجات البترولية الأخرى. وباستخدام التقارير المطلوبة من خدمات السكك الحديدية الأوروبية، حاول ديمتري إيفانوفيتش فك رموز طريقة صنع البارود الذي لا يدخن، والذي نجح فيه.

- كان لدى مندليف هواية - صنع الحقائب. قام العالم بخياطة ملابسه بنفسه.
- يعود الفضل للعالم في اختراع الفودكا و القمر. ولكن في الواقع، درس ديمتري إيفانوفيتش في موضوع أطروحة الدكتوراه "الخطاب حول مزيج الكحول مع الماء" مسألة تقليل حجم السوائل المختلطة. لم تكن هناك كلمة عن الفودكا في عمل العالم. وقد تم وضع معيار 40 درجة في روسيا القيصرية في عام 1843.
- لقد توصل إلى مقصورات مضغوطة للركاب والطيارين.
- هناك أسطورة مفادها أن اكتشاف نظام مندليف الدوري حدث في المنام، ولكن هذه أسطورة أنشأها العالم نفسه.
- قام بلف سجائره باستخدام التبغ باهظ الثمن. وقال إنه لن يقلع عن التدخين أبداً.
الاكتشافات
- لقد ابتكر منطادًا يمكن التحكم فيه، والذي أصبح مساهمة لا تقدر بثمن في مجال الطيران.
- قام بتطوير جدول دوري للعناصر الكيميائية، والذي أصبح تعبيرًا بيانيًا عن القانون الذي وضعه مندليف أثناء عمله على "أساسيات الكيمياء".
- لقد ابتكر مقياس البيكنومتر، وهو جهاز قادر على تحديد كثافة السائل.
- اكتشف نقطة الغليان الحرجة للسوائل.
- أنشأ معادلة الحالة للغاز المثالي، موضحًا العلاقة بين درجة الحرارة المطلقة للغاز المثالي والضغط والحجم المولي.
- افتتح الغرفة الرئيسية للأوزان والمقاييس - المؤسسة المركزية لوزارة المالية، التي كانت مسؤولة عن قسم التحقق في الإمبراطورية الروسية، التابع لإدارة التجارة.
يعتمد القانون الدوري والنظام الدوري للعناصر الكيميائية لـ D. I. Mendeleev على أفكار حول بنية الذرة.
1. صياغة القانون الدوري
D. I. Mendeleev في ضوء نظرية التركيب الذري.
كان اكتشاف القانون الدوري وتطوير النظام الدوري للعناصر الكيميائية بواسطة D. I. Mendeleev ذروة تطور الكيمياء في القرن التاسع عشر. تم جمع قدر هائل من المعرفة حول خصائص 63 عنصرًا معروفًا في ذلك الوقت.
D. I. يعتقد مندليف أن السمة الرئيسية للعناصر هي أوزانها الذرية، وفي عام 1869 قام بصياغة القانون الدوري لأول مرة.
تعتمد خصائص الأجسام البسيطة، وكذلك أشكال وخصائص مركبات العناصر، بشكل دوري على الأوزان الذرية للعناصر.
قام مندليف بتقسيم سلسلة العناصر بأكملها، مرتبة حسب زيادة كتلتها الذرية، إلى فترات تتغير خلالها خصائص العناصر بالتسلسل، ووضع الفترات بحيث يتم تسليط الضوء على العناصر المتشابهة.
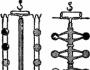
ومع ذلك، على الرغم من الأهمية الهائلة لمثل هذا الاستنتاج، فإن القانون الدوري ونظام مندليف لم يمثلا سوى تعميم رائع للحقائق، وظل معناها المادي غير واضح لفترة طويلة. فقط نتيجة لتطور فيزياء القرن العشرين - اكتشاف الإلكترون والنشاط الإشعاعي وتطوير نظرية التركيب الذري - أثبت الفيزيائي الإنجليزي الشاب الموهوب ج. موسل أن حجم شحنات النوى الذرية يزداد باستمرار من عنصر إلى عنصر بمقدار عنصر واحد. وبهذا الاكتشاف، أكد موسل التخمين الرائع لمندليف، الذي ابتعد في ثلاثة أماكن من الجدول الدوري عن التسلسل المتزايد للأوزان الذرية.
وهكذا، عند تجميعه، وضع مندليف 27 Co أمام 28 Ni، و52 Ti أمام 5 J، و18 Ar أمام 19 K، على الرغم من أن ذلك يتناقض مع صياغة القانون الدوري، أي الترتيب ترتيب العناصر حسب تزايد أوزانها الذرية .
وفقا لقانون موسلي، شحنات النوى من هذه العناصر يتوافق مع موقعها في الجدول.
فيما يتعلق باكتشاف قانون موسلي، فإن الصياغة الحديثة للقانون الدوري هي كما يلي:
تعتمد خصائص العناصر، وكذلك أشكال وخصائص مركباتها، بشكل دوري على شحنة نواة ذراتها.
العلاقة بين القانون الدوري والنظام الدوري وبنية الذرات.
لذلك، فإن السمة الرئيسية للذرة ليست الكتلة الذرية، ولكن حجم الشحنة الإيجابية للنواة. وهذه خاصية أكثر عمومية ودقة للذرة، وبالتالي فهي عنصر. تعتمد جميع خصائص العنصر وموقعه في الجدول الدوري على حجم الشحنة الموجبة للنواة الذرية. هكذا، يتطابق الرقم التسلسلي للعنصر الكيميائي عدديًا مع شحنة نواة ذرته. الجدول الدوري للعناصر هو تمثيل بياني للقانون الدوري ويعكس تركيب ذرات العناصر.
تشرح نظرية التركيب الذري التغيرات الدورية في خصائص العناصر. تؤدي زيادة الشحنة الموجبة للنواة الذرية من 1 إلى 110 إلى التكرار الدوري للعناصر الهيكلية لمستوى الطاقة الخارجي في الذرات. وبما أن خواص العناصر تعتمد بشكل أساسي على عدد الإلكترونات في المستوى الخارجي؛ ثم يكررون بشكل دوري. هذا هو المعنى المادي للقانون الدوري.
على سبيل المثال، النظر في التغيير في خصائص العنصرين الأول والأخير من الفترات. تبدأ كل فترة في النظام الدوري بعناصر من الذرات، والتي تحتوي على إلكترون واحد على المستوى الخارجي (المستويات الخارجية غير المكتملة) وبالتالي تظهر خصائص مماثلة - فهي تتخلى بسهولة عن إلكترونات التكافؤ، مما يحدد طابعها المعدني. هذه هي الفلزات القلوية - Li، Na، K، Rb، Cs.
وتنتهي الدورة بعناصر تحتوي ذراتها في المستوى الخارجي على 2 (س2) إلكترون (في الدورة الأولى) أو 8 (س1ف6) الإلكترونات (في جميع الإلكترونات اللاحقة)، أي أن لديها مستوى خارجي مكتمل. هذه هي الغازات النبيلة He، Ne، Ar، Kr، Xe، والتي لها خصائص خاملة.
إنه على وجه التحديد بسبب التشابه في بنية مستوى الطاقة الخارجي، فإن خواصها الفيزيائية والكيميائية متشابهة.
وفي كل فترة، مع زيادة العدد الترتيبي للعناصر، تضعف الخواص المعدنية تدريجيا وتزداد الخواص غير المعدنية، وتنتهي الدورة بغاز خامل. وفي كل فترة، مع زيادة العدد الترتيبي للعناصر، تضعف الخواص المعدنية تدريجيا وتزداد الخواص غير المعدنية، وتنتهي الدورة بغاز خامل.
في ضوء عقيدة بنية الذرة، يصبح واضحا تقسيم جميع العناصر إلى سبع فترات التي قام بها D. I. Mendeleev. ويتوافق رقم الدورة مع عدد مستويات الطاقة للذرة، أي أن موضع العناصر في الجدول الدوري يتم تحديده من خلال بنية ذراتها. اعتمادا على المستوى الفرعي المملوء بالإلكترونات، يتم تقسيم جميع العناصر إلى أربعة أنواع.
1. عناصر s. يتم ملء الطبقة الفرعية s للطبقة الخارجية (s 1 - s 2). وهذا يشمل العنصرين الأولين من كل فترة.
2. عناصر ف. المستوى الفرعي p للمستوى الخارجي مملوء (ص 1 -- ص 6) - ويشمل ذلك العناصر الستة الأخيرة من كل فترة، بدءاً من الثانية.
3. د- العناصر. يمتلئ المستوى الفرعي d من المستوى الأخير (d1 - d 10)، ويبقى 1 أو 2 إلكترون في المستوى (الخارجي) الأخير. وتشمل هذه عناصر العقود الإضافية (10) لفترات كبيرة، بدءًا من الرابع، وتقع بين العناصر s وp (وتسمى أيضًا العناصر الانتقالية).
4. عناصر f. المستوى الفرعي f للمستوى العميق (ثلثه الخارجي) مملوء (f 1 -f 14)، ويبقى هيكل المستوى الإلكتروني الخارجي دون تغيير. هذه هي اللانثانيدات والأكتينيدات، وتقع في الفترتين السادسة والسابعة.
وبالتالي، فإن عدد العناصر في الفترات (2-8-18-32) يتوافق مع الحد الأقصى لعدد الإلكترونات الممكنة عند مستويات الطاقة المقابلة: في الأول - اثنان، في الثاني - ثمانية، في الثالث - ثمانية عشر، و في الرابع - اثنان وثلاثون إلكترونًا. يعتمد تقسيم المجموعات إلى مجموعات فرعية (رئيسية وثانوية) على الاختلاف في ملء مستويات الطاقة بالإلكترونات. تتكون المجموعة الفرعية الرئيسية س- وعناصر ف، ومجموعة فرعية ثانوية - عناصر د. تجمع كل مجموعة عناصر تحتوي ذراتها على بنية مماثلة لمستوى الطاقة الخارجي. وفي هذه الحالة تحتوي ذرات عناصر المجموعات الفرعية الرئيسية في المستويات الخارجية (الأخيرة) على عدد من الإلكترونات يساوي رقم المجموعة. هذه هي ما يسمى إلكترونات التكافؤ.
بالنسبة لعناصر المجموعات الفرعية الجانبية، فإن إلكترونات التكافؤ ليست فقط المستويات الخارجية، بل أيضًا المستويات قبل الأخيرة (الخارجية الثانية)، وهو الفرق الرئيسي في خصائص عناصر المجموعات الفرعية الرئيسية والجانبية.
ويترتب على ذلك أن رقم المجموعة يشير عادة إلى عدد الإلكترونات التي يمكنها المشاركة في تكوين الروابط الكيميائية. هذا هو المعنى المادي لرقم المجموعة.
من وجهة نظر نظرية التركيب الذري، يمكن تفسير الزيادة في الخواص المعدنية للعناصر في كل مجموعة مع زيادة شحنة النواة الذرية بسهولة. مقارنة، على سبيل المثال، توزيع الإلكترونات حسب المستويات في الذرات 9 F (1s 2 2s 2 2r 5) و53J (1s 2 2s 2 2r 6 3s 2 zr 6 3د 10 4س 2 4 ص 6 4د 10 5s 2 5p 5) يمكن ملاحظة أن لديهم 7 إلكترونات في المستوى الخارجي مما يدل على تشابه الخصائص. ومع ذلك، فإن الإلكترونات الخارجية في ذرة اليود تكون أبعد عن النواة، وبالتالي فهي أقل إحكامًا. لهذا السبب، يمكن لذرات اليود التبرع بالإلكترونات، أو بمعنى آخر، إظهار خصائص معدنية، وهي ليست نموذجية للفلور.
لذا، فإن بنية الذرات تحدد نمطين:
أ) التغير في خصائص العناصر أفقيًا - خلال الفترة، من اليسار إلى اليمين، تضعف الخواص المعدنية وتتعزز الخواص غير المعدنية؛
ب) التغيير في خصائص العناصر عموديًا - في المجموعة، مع زيادة الرقم التسلسلي، تزداد الخواص المعدنية وتضعف الخواص غير المعدنية.
هكذا: مع زيادة شحنة نواة ذرات العناصر الكيميائية فإن بنية أغلفتها الإلكترونية تتغير بشكل دوري، وهذا هو سبب التغير الدوري في خواصها.
3. الهيكل دورية أنظمة D. I. Mendeleev.
النظام الدوري لـ D. I. ينقسم مندليف إلى سبع فترات - تسلسلات أفقية للعناصر مرتبة بترتيب متزايد من العدد الذري، وثماني مجموعات - تسلسلات من العناصر بنفس النوع من التكوين الإلكتروني للذرات وخصائص كيميائية مماثلة.
الفترات الثلاث الأولى تسمى صغيرة، والباقي - كبيرة. تتضمن الفترة الأولى عنصرين، الفترتان الثانية والثالثة - ثمانية لكل منهما، الرابعة والخامسة - ثمانية عشر عنصرًا، السادسة - اثنان وثلاثون، السابعة (غير مكتملة) - واحد وعشرون عنصرًا.
تبدأ كل فترة (ما عدا الأولى) بفلز قلوي وتنتهي بغاز خامل.
تسمى عناصر الفترتين 2 و 3 بالنموذجية.
تتكون الفترات الصغيرة من صف واحد، والفترات الكبيرة - من صفين: زوجي (علوي) وفردي (سفلي). توجد المعادن في صفوف زوجية لفترات كبيرة، وتتغير خصائص العناصر قليلاً من اليسار إلى اليمين. في الصفوف الفردية لفترات كبيرة، تتغير خصائص العناصر من اليسار إلى اليمين، كما هو الحال في عناصر الدورة 2 و 3.
في النظام الدوري، لكل عنصر رمزه ورقمه التسلسلي، ويشار إلى اسم العنصر وكتلته الذرية النسبية. إحداثيات موضع العنصر في النظام هي رقم الفترة ورقم المجموعة.
يتم وضع العناصر ذات الأرقام التسلسلية 58-71، والتي تسمى اللانثانيدات، والعناصر ذات الأرقام 90-103 - الأكتينيدات - بشكل منفصل في أسفل الجدول.
تنقسم مجموعات العناصر، المحددة بالأرقام الرومانية، إلى مجموعات فرعية رئيسية وثانوية. تحتوي المجموعات الفرعية الرئيسية على 5 عناصر (أو أكثر). وتشمل المجموعات الفرعية الثانوية عناصر الفترات التي تبدأ من الرابعة.
يتم تحديد الخواص الكيميائية للعناصر من خلال بنية ذرتها، أو بالأحرى بنية الغلاف الإلكتروني للذرات. تسمح لنا مقارنة بنية الأصداف الإلكترونية بموضع العناصر في الجدول الدوري بتحديد عدد من الأنماط المهمة:
1. رقم الدورة يساوي العدد الإجمالي لمستويات الطاقة المملوءة بالإلكترونات في ذرات عنصر معين.
2. في الفترات الصغيرة والسلاسل الفردية من الفترات الكبيرة، مع زيادة الشحنة الموجبة للنواة، يزداد عدد الإلكترونات في مستوى الطاقة الخارجي. ويرتبط ذلك بإضعاف العناصر المعدنية وتعزيز الخواص غير المعدنية للعناصر من اليسار إلى اليمين.
يشير رقم المجموعة إلى عدد الإلكترونات التي يمكنها المشاركة في تكوين الروابط الكيميائية (إلكترونات التكافؤ).
في المجموعات الفرعية، مع زيادة الشحنة الموجبة لنواة ذرات العناصر، تصبح خصائصها المعدنية أقوى وتضعف خصائصها غير المعدنية.
المزيد من قسم الكيمياء:
- الملخص: دراسة الأنماط الأساسية للتفاعلات الكيميائية
دي. مندليف حول التعليم العام
لقد سعى باستمرار إلى فكرة أن المدرسة هي قوة ضخمة تحدد مصائر الشعوب والدول، ويعتقد أنه دون توسيع التعليم العام، فإن تطوير روسيا أمر مستحيل.
في المقالات والخطب حول الدولة وتطوير التعليم في روسيا، أعرب D. I. Mendeleev عن الاعتبارات الأساسية التالية: التعليم العام هو واجب الدولة تجاه الطبقات الدنيا. وفي الوقت نفسه، لا يتوفر في البلاد حتى التعليم العام الأساسي لغالبية الأطفال، وخاصة في القرى. يجب وضع خطة وطنية لتطوير شبكة المدارس وتوفير صندوق نقدي خاص لتنفيذ هذه الخطة؛ المبادئ الأساسية لتنظيم التعليم العام هي عالميته وإلزاميته ومجانيته.
كان مندليف ماديًا عفويًا، وثوريًا في العلوم، وحارب المدرسة والميتافيزيقا والجهل وأطلق على نفسه اسم الواقعي. كان ديمتري إيفانوفيتش يعتقد أن التعليم يجب أن يقوم على "الواقعية الحياتية" بدلاً من الكلاسيكية، وكان من دعاة توسيع مسار العلوم الطبيعية على حساب اللغات القديمة. وفي رأيه أن أساس التعليم العام يجب أن يكون اللغة الروسية والرياضيات والعلوم الطبيعية. D. I. جادل منديليف بأنه من الضروري التدريس ليس للأغراض الشخصية، ولكن للأغراض العامة. وكان يكرر باستمرار: “سيأتي البذر العلمي لحصاد الشعب”.
في عام 1871، كتب دي آي مينديليف أن المؤسسات التعليمية لا يمكن أن تحقق أكبر فائدة إلا إذا كانت هناك استمرارية في التعليم: "أعني بهذا فرصة الطلاب الموهوبين في المدارس الدنيا للانتقال دون عوائق إلى المؤسسات العليا". لقد صاغ مبدأين للاستمرارية في التدريب والتعليم: أولاً، استقلالية واستقرار محتوى التعليم في كل مرحلة؛ ثانياً، العلاقة الوثيقة بين التعليم الابتدائي والثانوي والعالي.
D. I. أصر منديليف على إدخال التعليم الابتدائي الإلزامي وتمويل الدولة للتعليم. هل كان يتخيل أن التعليم الثانوي سيكون إلزاميا هذه الأيام؟
يعتقد D. I. Mendeleev أن التعليم يجب أن يكون في متناول جميع الطبقات.
دي. مندليف عن المدرسة الثانوية
دي. يعتقد مندليف أن المهمة الرئيسية للتعليم الثانوي هي تنمية شخصية الطلاب، والموقف الواعي تجاه البيئة، والعمل الجاد، والملاحظة، والقدرة على مناقشة القضايا المهمة. لقد كان مؤيدًا لخطة دراسية مدروسة بدقة في المدرسة الثانوية وطالب بنظام معين للفصول الدراسية وجدول زمني ثابت.
سعى العالم إلى طرد جميع مظاهر الشكلية، والتعلم عن ظهر قلب، واللغات الميتة (اللاتينية واليونانية)، وإدراج المواد الحيوية في المناهج الدراسية من المدرسة الثانوية. ويرى مندليف أن التدريس يجب أن يرتكز على دراسة الواقع المحيط من خلال الخبرة والملاحظة والتحليل والتعميم، أي أنه دعا إلى تكثيف عملية التعلم. أكد D. I. Mendeleev أن التفكير دون التحقق التجريبي يؤدي دائمًا إلى خداع الذات والأوهام، إلى التناقض بين الأقوال والأفعال، إلى الأنانية المهنية، التي لا تحتاجها الدولة على الإطلاق وتؤدي بالكثير من الناس إلى أحلام اليقظة والخمول، وأحيانًا إلى خيبة الأمل واليأس.
إن موقف ديمتري إيفانوفيتش تجاه الامتحانات في المدرسة الثانوية مثير للاهتمام. وكتب في مقال "الامتحانات" "... يجب إلغاء الامتحانات الشفهية الجماعية أثناء التدريب، ولا ينبغي النظر إلى امتحانات القبول إلا كضرورة حتمية تحددها العلاقة بين الطلب والعرض".
"... الامتحانات، وخاصة الشفهية، هي دائمًا نوع من اليانصيب ... لقد حان الوقت لإنهاء هذا"
كان مندليف غاضبًا بشكل خاص من تقييم عمل المعلمين بناءً على نتائج امتحانات طلابهم. وشدد على أن اختبار المعلمين ضروري بالطبع، ولكن ينبغي أولا وقبل كل شيء أن يتم إجراؤه عند اختيار المعلمين. يجب اختبار المعلمين ليس أثناء الامتحانات، ولكن أثناء التدريس.
D. I. Mendeleev، تقديرا كبيرا لعمل المعلم، قدم أخطر المطالب عليه. ورأى أن المرشح لمنصب المعلم يجب أن يكون لديه معرفة شاملة بطرق تدريس الكيمياء، واقترح إنشاء قسم لعلم أصول التدريس في كل جامعة. الآن كل مؤسسة تعليمية لديها لجنة منهجية للكيمياء. كتب مندليف: "إن العمل الحقيقي للمعلم يتم بواسطة الأعصاب حصريًا ... التفكير الجاف وحده - حتى مع الضمير الكامل - لا يمكن فعل أي شيء في التدريس، ولن تترك كلمة طيبة، عمل الأعصاب وهناك حاجة..."
أطلق ديمتري إيفانوفيتش على المعلمين اسم المصابيح والمعلمين، وأصر على اتباعهم للعلم، والمشاركة فيه بشكل مباشر،
لأن ذلك المعلم وحده هو الذي يمكنه التأثير بشكل مثمر على طلابه، وتجديد معرفتهم، وهو نفسه قوي في العلوم.
D. I. أكد منديليف بشكل خاص على الدور التعليمي للمعلم، حيث يجب عليه أن يعرف كل طالب وقدراته وميوله وشخصيته من أجل تطوير ميوله الحالية بشكل شامل. في حياته الشخصية، يجب أن يكون المعلم قدوة للطلاب. الثقة بالمعلم هي أساس كل تعليم.
#دميتري مندلييف#قصة #الروسية العظيمة#مندليف #الكيمياء #التعليم
ولد ديمتري إيفانوفيتش مندليف في فبراير 1834 في مدينة توبولسك، في عائلة مدير صالة للألعاب الرياضية المحلية.أصبح والده في عام ولادة ديمتري أعمى في كلتا عينيه، ونتيجة لذلك، اضطر إلى ترك الخدمة والذهاب إلى معاش تقاعدي ضئيل. تربية الأطفال وكل المخاوف بشأن عائلة كبيرة تقع بالكامل على عاتق الأم، ماريا دميترييفنا، وهي امرأة نشطة وذكية، من أجل تحسين الوضع المالي للأسرة، تولت إدارة مصنع الزجاج الخاص بشقيقها الذي يقع على بعد 25 كم من توبولسك. في عام 1848، احترق مصنع الزجاج، وانتقلت عائلة مندلييف إلى موسكو للعيش مع شقيق والدتهم. في عام 1850، بعد الكثير من المتاعب، دخل ديمتري إيفانوفيتش قسم الفيزياء والرياضيات في معهد سانت بطرسبرغ التربوي. في عام 1855، تخرج بميدالية ذهبية وتم إرساله كمدرس للصالة الرياضية، أولاً إلى سيمفيروبول، ثم إلى أوديسا. ومع ذلك، لم يبقى مندليف في هذا المنصب لفترة طويلة.
بالفعل في عام 1856، ذهب إلى سانت بطرسبرغ ودافع عن أطروحة الماجستير حول موضوع "في مجلدات محددة"، وبعد ذلك في بداية عام 1857 تم قبوله كأستاذ مساعد خاص في قسم الكيمياء بجامعة سانت بطرسبرغ. 1859 - 1861 قضى رحلة علمية إلى ألمانيا، في جامعة هايدلبرغ، حيث كان محظوظا للعمل تحت إشراف العلماء البارزين بنسن وكيرشوف. في عام 1860، شارك مندلييف في المؤتمر الكيميائي الدولي الأول في كارلسروه. هنا كان مهتمًا بشدة بتقرير الكيميائي الإيطالي كانيزارو. "اللحظة الحاسمة في تطور أفكاري حول القانون الدوري"، قال بعد سنوات عديدة، "أفكر في عام 1860، مؤتمر الكيميائيين في كارلسروه... والأفكار التي عبر عنها الكيميائي الإيطالي كانيزارو في هذا المؤتمر. أنا أعتبره سلفي الحقيقي، حيث أن الأوزان الذرية التي أنشأها قدمت نقطة الارتكاز اللازمة... فكرة الدورية المحتملة لخصائص العناصر ذات الوزن الذري المتزايد، في جوهرها، ظهرت لي بالفعل داخليًا.. ".
عند العودة إلى سانت بطرسبرغ، بدأ مندليف نشاطًا علميًا نشطًا. في عام 1861، كتب في غضون أشهر قليلة أول كتاب مدرسي عن الكيمياء العضوية في روسيا. حقق الكتاب نجاحًا كبيرًا حيث بيعت طبعته الأولى في غضون بضعة أشهر وكان لا بد من إصدار طبعة ثانية في العام التالي. في ربيع عام 1862، حصل الكتاب المدرسي على جائزة ديميدوف الكاملة. بهذه الأموال، قام Mendeleev برحلة إلى الخارج في الصيف مع زوجته الشابة Feozva Nikitichnaya Leshcheva. (لم يكن هذا الزواج ناجحا للغاية - في عام 1881 طلق مندليف زوجته الأولى، وفي أبريل 1882 تزوج من الفنانة الشابة آنا إيفانوفنا بوبوفا.) في عام 1863 حصل على الأستاذية في معهد سانت بطرسبرغ للتكنولوجيا، وفي عام 1866 - في جامعة سانت بطرسبرغ، حيث حاضر في الكيمياء العضوية وغير العضوية والتقنية. في عام 1865، دافع مندلييف عن أطروحته للدكتوراه حول موضوع "حول مزيج الكحول مع الماء".
في عام 1866، استحوذ منديليف على عقار بوبلوفو بالقرب من كلين، والذي ارتبطت به حياته المستقبلية بأكملها. تمت كتابة العديد من أعماله هنا. وفي أوقات فراغه، كان متحمسًا جدًا للزراعة في الحقل التجريبي الذي أنشأه، حيث قام باختبار الأسمدة المختلفة. تم تفكيك المنزل الخشبي القديم على مدار عدة سنوات، وتم بناء منزل حجري جديد مكانه. ظهر نموذج للحظيرة ومنتجات الألبان والإسطبل. تم إحضار آلة الدرس التي طلبها مندليف إلى الحوزة.
في عام 1867، انتقل مندليف إلى جامعة سانت بطرسبرغ كأستاذ للكيمياء وكان من المفترض أن يلقي محاضرة عن الكيمياء غير العضوية.
بعد أن بدأ في إعداد المحاضرات، اكتشف أنه لا يوجد في روسيا ولا في الخارج دورة في الكيمياء العامة تستحق التوصية بها للطلاب. وبعد ذلك قرر أن يكتبها بنفسه. تم نشر هذا العمل الأساسي، المسمى "أساسيات الكيمياء"، في أعداد منفصلة على مدار عدة سنوات. تم الانتهاء من العدد الأول، الذي يحتوي على مقدمة، والنظر في القضايا العامة للكيمياء، ووصف خصائص الهيدروجين والأكسجين والنيتروجين، بسرعة نسبيا - ظهر في صيف عام 1868. ولكن أثناء العمل في العدد الثاني، واجه مندليف الكثير الصعوبات المرتبطة بتنظيم واتساق عرض المواد . في البداية أراد تجميع كل العناصر التي وصفها بالتكافؤ، لكنه بعد ذلك اختار طريقة مختلفة وجمعها في مجموعات منفصلة، بناءً على تشابه الخصائص والوزن الذري. إن التفكير في هذا السؤال جعل مندليف يقترب من الاكتشاف الرئيسي في حياته.
حقيقة أن بعض العناصر الكيميائية تظهر تشابهات واضحة لم تكن سرا لأي كيميائي في تلك السنوات. إن أوجه التشابه بين الليثيوم والصوديوم والبوتاسيوم، وبين الكلور والبروم واليود، أو بين الكالسيوم والسترونتيوم والباريوم، كانت ملفتة للنظر لأي شخص. في عام 1857، قام الكيميائي السويدي لينسن بدمج العديد من "الثالوثات" من خلال التشابه الكيميائي: الروثينيوم - الروديوم - البلاديوم؛ الأوزميوم - البلاتين ~ - الإيريديوم؛ المنغنيز - الحديد - الكوبالت. حتى أنه تم إجراء محاولات لتجميع جداول العناصر. تحتوي مكتبة منديليف على كتاب للكيميائي الألماني جملين، الذي نشر مثل هذا الجدول في عام 1843. وفي عام 1857، اقترح الكيميائي الإنجليزي أودلينج نسخته الخاصة.
ومع ذلك، لم يغطي أي من الأنظمة المقترحة المجموعة الكاملة للعناصر الكيميائية المعروفة. على الرغم من أن وجود مجموعات منفصلة وعائلات منفصلة يمكن اعتباره حقيقة ثابتة، إلا أن العلاقة بين هذه المجموعات ظلت غير واضحة تمامًا.
تمكن مندليف من العثور عليه من خلال ترتيب جميع العناصر حسب زيادة الكتلة الذرية. يتطلب إنشاء نمط دوري قدرًا هائلاً من التفكير منه. بعد أن كتب على بطاقات منفصلة أسماء العناصر التي تشير إلى وزنها الذري وخصائصها الأساسية، بدأ مندليف في ترتيبها في مجموعات مختلفة، وإعادة ترتيبها وتغيير أماكنها. وكان الأمر معقدًا جدًا لأن العديد من العناصر لم تكن مكتشفة بعد في ذلك الوقت، وتم تحديد الأوزان الذرية لتلك المعروفة بالفعل بمغالطات كبيرة. ومع ذلك، سرعان ما تم اكتشاف النمط المطلوب. تحدث مندليف نفسه بهذه الطريقة عن اكتشافه للقانون الدوري: "بعد أن اشتبهت في وجود علاقة بين العناصر في سنوات دراستي، لم أتعب أبدًا من التفكير في هذه المشكلة من جميع الجوانب، وجمع المواد، ومقارنة الأرقام ومقارنتها. وأخيراً، جاء الوقت الذي أصبحت فيه المشكلة ناضجة، وبدا أن الحل على وشك أن يتشكل في رأسي. وكما حدث دائماً في حياتي، فإن هاجس الحل الوشيك للمسألة التي عذبتني قادني إلى حالة من الفوضى. حالة حماس. لعدة أسابيع كنت أنام بشكل متقطع، في محاولة للعثور على ذلك المبدأ السحري الذي من شأنه أن يرتب على الفور كومة المواد المتراكمة على مدى خمسة عشر عاما. وفي صباح أحد الأيام، بعد أن أمضيت ليلة بلا نوم ويأسي من إيجاد حل، استلقيت على الأريكة دون خلع ملابسي في المكتب ونمت. "وفي الحلم، ظهرت لي الطاولة بوضوح تام. استيقظت على الفور ورسمت الطاولة التي رأيتها في المنام على أول قطعة من الورق وصلت إلى يدي."
في فبراير 1869، أرسل مندليف إلى الكيميائيين الروس والأجانب، مطبوعًا على ورقة منفصلة، "تجربة على نظام من العناصر يعتمد على وزنها الذري وتشابهها الكيميائي". في 6 مارس، في اجتماع للجمعية الكيميائية الروسية، تمت قراءة رسالة حول تصنيف العناصر التي اقترحها مندليف. كانت هذه النسخة الأولى من الجدول الدوري مختلفة تمامًا عن الجدول الدوري الذي اعتدنا عليه في المدرسة.
تم ترتيب المجموعات أفقياً وليس رأسياً، وكان العمود الفقري للجدول يتكون من مجموعات متجاورة من الفلزات القلوية والهالوجينات. فوق الهالوجينات كانت مجموعة الأكسجين (الكبريت، السيلينيوم، التيلوريوم)، وفوقها كانت مجموعة النيتروجين (الفوسفور، الزرنيخ، الأنتيمون، البزموت). والأعلى من ذلك هي مجموعة الكربون (السيليكون والقصدير، حيث ترك مندليف خلية فارغة لعنصر غير معروف بكتلة تقريبية تبلغ 70 وحدة دولية، والتي احتلها لاحقًا الجرمانيوم بكتلة 72 وحدة دولية). وفوق مجموعة الكربون تم وضع مجموعة الكربون. مجموعات البورون والبريليوم. وتحت الفلزات القلوية كانت هناك مجموعة من الفلزات القلوية الترابية وغيرها. وقد تم وضع عدة عناصر، كما تبين لاحقا، في غير مكانها في هذه النسخة الأولى. وهكذا وقع الزئبق في مجموعة النحاس واليورانيوم والذهب - في مجموعة الألومنيوم، والثاليوم - في مجموعة الفلزات القلوية، والمنجنيز - في نفس المجموعة مع الروديوم والبلاتين، وانتهى الأمر بالكوبالت والنيكل عمومًا في نفس المجموعة. خلية. لكن كل هذه الأخطاء لا ينبغي أن تنتقص على الإطلاق من أهمية الاستنتاج نفسه: من خلال مقارنة خصائص العناصر المدرجة في الأعمدة الرأسية، يمكن للمرء أن يرى بوضوح أنها تتغير بشكل دوري مع زيادة الوزن الذري. كان هذا هو الشيء الأكثر أهمية في اكتشاف مندليف، والذي جعل من الممكن ربط جميع مجموعات العناصر التي كانت تبدو متباينة سابقًا. لقد أوضح مندليف بشكل صحيح الاضطرابات غير المتوقعة في هذه السلسلة الدورية من خلال حقيقة أنه ليست كل العناصر الكيميائية معروفة للعلم. ترك في طاولته أربع خلايا فارغة، لكنه تنبأ بالوزن الذري والخصائص الكيميائية لهذه العناصر. كما قام بتصحيح العديد من الكتل الذرية المحددة بشكل غير دقيق للعناصر، وأكدت الأبحاث الإضافية صحتها تمامًا.
تمت إعادة بناء المسودة الأولى للجدول، التي لا تزال غير كاملة، في السنوات التالية. بالفعل في عام 1869، وضع مندليف الهالوجينات والمعادن القلوية ليس في وسط الطاولة، ولكن على طول حوافها (كما هو الحال الآن). انتهت جميع العناصر الأخرى داخل الهيكل وكانت بمثابة انتقال طبيعي من طرف إلى آخر. جنبا إلى جنب مع المجموعات الرئيسية، بدأ Mendeleev في التمييز بين المجموعات الفرعية (وهكذا، تم تشكيل الصف الثاني من مجموعتين فرعيتين: البريليوم - المغنيسيوم - الكالسيوم - السترونتيوم - الباريوم والزنك - الكادميوم - الزئبق). وفي السنوات التالية، صحح مندليف الأوزان الذرية لـ 11 عنصرًا وغير موقع 20. ونتيجة لذلك، في عام 1871، ظهر مقال "القانون الدوري للعناصر الكيميائية"، والذي اتخذ فيه الجدول الدوري شكلًا حديثًا تمامًا. تمت ترجمة المقال إلى الألمانية وأرسلت نسخ منه إلى العديد من الكيميائيين الأوروبيين المشهورين. لكن، للأسف، لم يتوقع منديليف منهم ليس فقط حكمًا مختصًا، بل حتى إجابة بسيطة. ولم يقدر أي منهم أهمية الاكتشاف الذي توصل إليه. لم يتغير الموقف تجاه القانون الدوري إلا في عام 1875، عندما اكتشف Lecoq de Boisbaudran عنصرًا جديدًا - الغاليوم، الذي تزامنت خصائصه بشكل لافت للنظر مع تنبؤات مندليف (أطلق على هذا العنصر غير المعروف اسم التوازن).
كان انتصار مندليف الجديد هو اكتشاف السكانديوم في عام 1879، والجرمانيوم في عام 1886، والذي تتوافق خصائصه أيضًا تمامًا مع أوصاف مندليف.
حددت أفكار القانون الدوري بنية "أساسيات الكيمياء" (تم نشر الطبعة الأخيرة من الدورة مع الجدول الدوري المرفق بها في عام 1871) وأعطت هذا العمل تناغمًا وأساسية مذهلة. ومن حيث قوة التأثير على الفكر العلمي، يمكن بسهولة مقارنة "مبادئ الكيمياء" لمندليف مع أعمال الفكر العلمي البارزة مثل "مبادئ الفلسفة الطبيعية" لنيوتن، و"محادثات حول نظامي العالم" لجاليليو. داروين "أصل الأنواع". تم تقديم جميع المواد الواقعية الهائلة التي تراكمت بحلول هذا الوقت في مختلف فروع الكيمياء هنا لأول مرة في شكل نظام علمي متماسك. تحدث مندليف نفسه عن الكتاب المدرسي الذي أنشأه: "هذه "الأساسيات" هي من بنات أفكاري المفضلة. إنها تحتوي على صورتي، وتجربتي كمعلمة، وأفكاري العلمية الصادقة. إن الاهتمام الهائل الذي أظهره المعاصرون والأحفاد بهذا الكتاب يتوافق تمامًا مع رأي المؤلف نفسه. خلال حياة مندليف وحدها، صدر كتاب "أساسيات الكيمياء" بثماني طبعات، وتُرجم إلى اللغات الأوروبية الرئيسية.
في السنوات اللاحقة، تم نشر العديد من الأعمال الأساسية في مختلف فروع الكيمياء من قلم مندليف. (تراثه العلمي والأدبي الكامل هائل ويحتوي على 431 عملاً منشورًا.) في منتصف الثمانينات. قام بدراسة المحاليل لعدة سنوات، وكانت نتيجتها كتاب “دراسة المحاليل المائية بالجاذبية النوعية” الذي نشر عام 1887، والذي اعتبره مندليف من أفضل أعماله، وقد انطلق في نظريته عن المحاليل من حقيقة أن المذيب هو وسط غير مبال يتم فيه تخلخل جسم مذاب، ولكنه كاشف فعال يتغير أثناء عملية الذوبان، وهذا الذوبان ليس عملية ميكانيكية، بل عملية كيميائية. على العكس من ذلك، يعتقد أنصار النظرية الميكانيكية لتكوين المحاليل أنه لا تنشأ أي مركبات كيميائية أثناء الذوبان، وأن جزيئات الماء، التي تتحد بنسب محددة بدقة مع جزيئات المادة، تشكل أولاً محلولًا مركَّزًا، وهو الخليط الميكانيكي من الذي يعطي مع الماء محلولاً مخففاً.
تخيل مندليف هذه العملية بشكل مختلف - عند دمجها مع جزيئات مادة ما، تشكل جزيئات الماء العديد من الهيدرات، ومع ذلك، فإن بعضها هش للغاية لدرجة أنه يتفكك على الفور - ينفصل. تتحد نواتج هذا التحلل مرة أخرى مع المادة، ومع المذيب والهيدرات الأخرى، وتتفكك بعض المركبات المتكونة حديثًا مرة أخرى، وتستمر العملية حتى ينشأ توازن متحرك - ديناميكي - في المحلول.
كان مندليف نفسه واثقًا من صحة مفهومه، ولكن على عكس التوقعات، لم يسبب عمله الكثير من الصدى بين الكيميائيين، لأنه في نفس عام 1887 ظهرت نظريتان أخريان للحلول - التناضحي لفان هوف والتحليل الكهربائي لأرينيوس - والذي كان مثاليًا وأوضح العديد من الظواهر المرصودة. لعدة عقود، تمكنوا من ترسيخ أنفسهم بشكل كامل في الكيمياء، مما دفع نظرية مندليف إلى الظل. ولكن في السنوات اللاحقة اتضح أن كلا من نظرية فانت هوف ونظرية أرهينيوس كان لهما نطاق تطبيق محدود. وهكذا فإن معادلات فانت هوف أعطت نتائج ممتازة بالنسبة للمواد العضوية فقط. تبين أن نظرية أرينيوس (التي بموجبها يحدث تحلل - تفكك - جزيئات الإلكتروليت (الأملاح والأحماض والقلويات) إلى أيونات موجبة وسالبة الشحنة في السائل) صالحة فقط للمحاليل الضعيفة للإلكتروليتات، لكنها لم تشرح الأسباب الرئيسية الشيء - كيف وبسبب أي قوى يحدث انقسام أقوى الجزيئات عندما تدخل الماء. بعد وفاة مندليف، كتب أرينيوس نفسه أن نظرية الهيدرات تستحق دراسة مفصلة، لأنها بالتحديد هي التي يمكن أن توفر المفتاح لفهم هذه القضية، وهي أصعب مسألة التفكك الإلكتروليتي. وهكذا، أصبحت نظرية مندلييف للترطيب، جنبًا إلى جنب مع نظرية المذابات لفانت هوف ونظرية التحليل الكهربائي لأرينيوس، جزءًا مهمًا من النظرية الحديثة للحلول.
حظيت أعمال مندليف باعتراف دولي واسع النطاق. انتخب عضوا في الأكاديميات الأمريكية والأيرلندية واليوغوسلافية والرومانية والبلجيكية والدنماركية والتشيكية وكراكوف والعديد من أكاديميات العلوم الأخرى، وعضوا فخريا في العديد من الجمعيات العلمية الأجنبية. فقط الأكاديمية الروسية للعلوم صوتت لصالحه في انتخابات عام 1880 بسبب نوع من المؤامرات الداخلية.
بعد تقاعده في عام 1890، قام مندلييف بدور نشط في نشر قاموس بروكهاوس وإيفرون الموسوعي، ثم عمل لعدة سنوات كمستشار في مختبر البارود في الوزارة البحرية. قبل ذلك، لم يكن منخرطًا على وجه التحديد في المتفجرات، ولكن بعد إجراء الأبحاث اللازمة، قام في ثلاث سنوات فقط بتطوير تركيبة فعالة للغاية من البارود الذي لا يدخن، والذي تم إدخاله في الإنتاج. في عام 1893، تم تعيين مندليف حارسًا (مديرًا) للغرفة الرئيسية للأوزان والمقاييس. توفي في فبراير 1907 بسبب الالتهاب الرئوي.