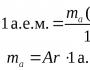रसायनशास्त्रातील सूत्रांचा संग्रह. समस्या सोडवण्यासाठी मूलभूत सूत्रे
|
विशालता आणि त्याचे परिमाण |
प्रमाण |
|
X घटकाचे अणु वस्तुमान (सापेक्ष) |
|
|
घटक अनुक्रमांक |
Z= एन(e –) = एन(आर +) |
|
पदार्थ X मधील घटक E चा वस्तुमान अपूर्णांक, युनिटच्या अपूर्णांकांमध्ये, % मध्ये) |
|
|
पदार्थाचे प्रमाण X, mol | |
|
गॅस पदार्थाचे प्रमाण, mol |
विहीर. आर- = 101 325 Pa,ट |
|
= 273 के |
|
|
पदार्थाचे मोलर मास X, g/mol, kg/mol |
मीपदार्थाचे वस्तुमान X, g, kg (X) = n (X)एम |
|
(X) |
व्ही मीवायूचे मोलर व्हॉल्यूम, l/mol, m 3/mol |
|
= 22.4 l/mol N.S. |
व्ही = व्ही मी × (X) = |
|
गॅस व्हॉल्यूम, m3 |
|
|
उत्पादन उत्पन्न |
|
|
पदार्थाची घनता X, g/l, g/ml, kg/m3 |
|
|
हायड्रोजनद्वारे वायू पदार्थ X ची घनता |
हवेतील वायू पदार्थ X ची घनताएम |
|
(हवा) = २९ ग्रॅम/मोल |
|
|
युनायटेड गॅस कायदा |
मेंडेलीव्ह-क्लेपीरॉन समीकरण = पी.व्ही, nRTआर |
|
= 8.314 J/mol×K |
|
|
वायूंच्या मिश्रणात वायूयुक्त पदार्थाचा खंड अपूर्णांक, युनिटच्या अंशांमध्ये किंवा % मध्ये |
|
|
वायूंच्या मिश्रणाचे मोलर वस्तुमान |
|
|
मिश्रणातील पदार्थाचा तीळ (X) अंश |
उष्णतेचे प्रमाण, J, kJ = (X) = n उष्णतेचे प्रमाण, J, kJएम |
|
प्र |
प्रतिक्रियेचा थर्मल प्रभावप्रश्न =– |
|
एच |
|
|
पदार्थाच्या निर्मितीची उष्णता X, J/mol, kJ/mol |
|
|
रासायनिक अभिक्रिया दर (mol/lsec) सामूहिक कृतीचा कायदा |
(साध्या प्रतिक्रियेसाठी) a A+व्ही B=सह क + d डी = u B= (साध्या प्रतिक्रियेसाठी) k B= (अ)व्ही |
|
(ब) |
|
|
व्हॅनट हॉफचा नियम |
|
|
पदार्थाची विद्राव्यता (X) (g/100 g विलायक) |
|
|
A + X मिश्रणातील पदार्थ X चा वस्तुमान अपूर्णांक, युनिटच्या अपूर्णांकांमध्ये, % मध्ये |
मीद्रावणाचे वजन, g, kg मी(rr) = मी(X)+ मीद्रावणाचे वजन, g, kg व्ही(H2O) (rr) |
|
(rr) |
|
|
द्रावणातील विरघळलेल्या पदार्थाचा वस्तुमान अंश, युनिटच्या अपूर्णांकांमध्ये,% मध्ये |
|
|
समाधान घनता |
|
|
द्रावणाची मात्रा, सेमी 3, l, m 3 |
|
|
मोलर एकाग्रता, mol/l |
|
|
इलेक्ट्रोलाइट पृथक्करणाची डिग्री (X), युनिटच्या अंशांमध्ये किंवा % |
पाण्याचे आयनिक उत्पादनके |
|
(H2O) = |
pH मूल्य |
pH = –lg
मुख्य:कुझनेत्सोव्हा एन.ई. आणि इ
. रसायनशास्त्र. 8वी श्रेणी-10वी श्रेणी – एम.: वेंटाना-ग्राफ, 2005-2007.कुझनेत्सोवा एन.ई., लिटविनोव्हा टी.एन., लेव्हकिन ए.एन.
रसायनशास्त्र. 2 भागांमध्ये 11 वी श्रेणी, 2005-2007.एगोरोव ए.एस.
रसायनशास्त्र. विद्यापीठांच्या तयारीसाठी नवीन पाठ्यपुस्तक. रोस्तोव एन/डी: फिनिक्स, 2004.- 640 पी.
रसायनशास्त्र. 2 भागांमध्ये 11 वी श्रेणी, 2005-2007.एगोरोव ए.एस. रसायनशास्त्र: युनिफाइड स्टेट परीक्षेच्या तयारीसाठी एक आधुनिक अभ्यासक्रम. रोस्तोव n/a: फिनिक्स, 2011. (2012) – 699 p.
रासायनिक समस्यांचे निराकरण करण्यासाठी स्वयं-सूचना पुस्तिका. – रोस्तोव-ऑन-डॉन: फिनिक्स, 2000. – 352 पी.
विद्यापीठांमध्ये अर्जदारांसाठी रसायनशास्त्र/शिक्षक पुस्तिका. रोस्तोव-एन/डी, फिनिक्स, 2005– 536 पी.खोमचेन्को G.P., Khomchenko I.G.
. विद्यापीठांमध्ये अर्जदारांसाठी रसायनशास्त्रातील समस्या. एम.: उच्च शाळा. 2007.–302p.
अतिरिक्त:. रसायनशास्त्रातील केंद्रीकृत चाचणीच्या तयारीसाठी शैक्षणिक आणि प्रशिक्षण साहित्य / A.I. व्रुब्लेव्स्की –Mn.: Unipress LLC, 2004. – 368 p.
अतिरिक्त:. शालेय मुले आणि अर्जदारांसाठी चेन ऑफ ट्रान्सफॉर्मेशन्स आणि कंट्रोल टेस्टसह रसायनशास्त्रातील 1000 समस्या – Mn.: Unipress LLC, 2003. – 400 p.
एगोरोव ए.एस.. युनिफाइड स्टेट परीक्षेच्या तयारीसाठी रसायनशास्त्रातील सर्व प्रकारच्या गणना समस्या – रोस्तोव एन/डी: फिनिक्स, 2003. – 320 पी.
एगोरोव ए.एस., अमिनोवा जी.के.एच.. रसायनशास्त्र परीक्षेच्या तयारीसाठी ठराविक कार्ये आणि व्यायाम. – रोस्तोव एन/डी: फिनिक्स, 2005. – 448 पी.
युनिफाइड स्टेट परीक्षा 2007. रसायनशास्त्र. विद्यार्थ्यांच्या तयारीसाठी शैक्षणिक आणि प्रशिक्षण साहित्य / FIPI - M.: Intellect-Center, 2007. – 272 p.
युनिफाइड स्टेट परीक्षा 2011. रसायनशास्त्र. शैक्षणिक आणि प्रशिक्षण किट एड. ए.ए. कावेरीना - एम.: राष्ट्रीय शिक्षण, 2011.
युनिफाइड स्टेट परीक्षेची तयारी करण्यासाठी कार्यांसाठी एकमेव वास्तविक पर्याय. युनिफाइड स्टेट एक्झामिनेशन 2007. रसायनशास्त्र/V.Yu. मिशिना, ई.एन. स्ट्रेलनिकोवा. एम.: फेडरल टेस्टिंग सेंटर, 2007.-151 पी.
कावेरीना ए.ए. विद्यार्थ्यांना तयार करण्यासाठी कार्यांची इष्टतम बँक. युनिफाइड स्टेट परीक्षा 2012. रसायनशास्त्र. पाठ्यपुस्तक./ A.A. कावेरीना, डी.यू. डोब्रोटिन, यु.एन. मेदवेदेव, एम.जी. स्नॅस्टिना - एम.: इंटेलेक्ट-सेंटर, 2012. - 256 पी.
लिटविनोवा टी.एन., व्यस्कुबोवा एन.के., अझिपा एल.टी., सोलोव्यवा एम.व्ही.. 10-महिन्याच्या पत्रव्यवहार पूर्वतयारी अभ्यासक्रमांच्या विद्यार्थ्यांसाठी चाचण्यांव्यतिरिक्त चाचणी कार्ये (पद्धतीसंबंधी सूचना). क्रास्नोडार, 2004. - पृष्ठ 18 - 70.
लिटविनोव्हा टी.एन.. रसायनशास्त्र. युनिफाइड स्टेट परीक्षा 2011. प्रशिक्षण चाचण्या. रोस्तोव एन/डी: फिनिक्स, 2011.- 349 p.
लिटविनोव्हा टी.एन.. रसायनशास्त्र. युनिफाइड स्टेट परीक्षेसाठी चाचण्या. रोस्तोव एन/डी.: फिनिक्स, 2012. - 284 पी.
लिटविनोव्हा टी.एन.. रसायनशास्त्र. कायदे, घटकांचे गुणधर्म आणि त्यांची संयुगे. रोस्तोव एन/डी.: फिनिक्स, 2012. - 156 पी.
लिटविनोवा टी.एन., मेलनिकोवा ई.डी., सोलोव्होवा एम.व्ही.., अझिपा एल.टी., व्यस्कुबोवा एन.के.विद्यापीठांमध्ये अर्जदारांसाठी केमिस्ट्री - एम.: ओनिक्स पब्लिशिंग हाऊस एलएलसी: मीर आणि एज्युकेशन पब्लिशिंग हाऊस एलएलसी, 2009. – 832 पी.
वैद्यकीय आणि जैविक वर्गांच्या विद्यार्थ्यांसाठी रसायनशास्त्रातील शैक्षणिक आणि पद्धतशीर कॉम्प्लेक्स, एड. टी.एन. लिटविनोवा - क्रास्नोडार.: केएसएमयू, - 2008.
रसायनशास्त्र. युनिफाइड स्टेट परीक्षा 2008. प्रवेश परीक्षा, अध्यापन सहाय्य/सं. व्ही.एन. डोरोनकिना. – रोस्तोव एन/ए: लीजन, 2008.- 271 पी.
रसायनशास्त्रावरील वेबसाइट्सची यादी:
1. अलहिमिक. http:// www. alhimik. ru
2. प्रत्येकासाठी रसायनशास्त्र. संपूर्ण रसायनशास्त्र अभ्यासक्रमासाठी इलेक्ट्रॉनिक संदर्भ पुस्तक.
http:// www. माहिती. ru/ मजकूर/ डेटाबेस/ रसायनशास्त्र/ सुरू करा. html
3. शालेय रसायनशास्त्र - संदर्भ पुस्तक. http:// www. शालेय रसायनशास्त्र. द्वारे. ru
4. रसायनशास्त्र शिक्षक. http://www. रसायनशास्त्र.nm.ru
इंटरनेट संसाधने
अलहिमिक. http:// www. alhimik. ru
प्रत्येकासाठी रसायनशास्त्र. संपूर्ण रसायनशास्त्र अभ्यासक्रमासाठी इलेक्ट्रॉनिक संदर्भ पुस्तक.
http:// www. माहिती. ru/ मजकूर/ डेटाबेस/ रसायनशास्त्र/ सुरू करा. html
शालेय रसायनशास्त्र - संदर्भ पुस्तक. http:// www. शालेय रसायनशास्त्र. द्वारे. ru
http://www.classchem.narod.ru
रसायनशास्त्राचे शिक्षक. http://www. रसायनशास्त्र.nm.ru
http://www.alleng.ru/edu/chem.htm- रसायनशास्त्रावरील शैक्षणिक इंटरनेट संसाधने
http://schoolchemistry.by.ru/- शालेय रसायनशास्त्र. या साइटवर विविध विषयांवर ऑन-लाइन चाचणी घेण्याची तसेच युनिफाइड स्टेट परीक्षेच्या डेमो आवृत्त्या घेण्याची संधी आहे.
रसायनशास्त्र आणि जीवन - XXI शतक: लोकप्रिय विज्ञान मासिक. http:// www. हिज. ru
शालेय रसायनशास्त्र अभ्यासक्रमासाठी मूलभूत सूत्रांचे संकलन
शालेय रसायनशास्त्र अभ्यासक्रमासाठी मूलभूत सूत्रांचे संकलन
जी.पी. लॉगिनोव्हा
एलेना सविंकिना
ई.व्ही. सविंकिना जी.पी. लॉगिनोवा
रसायनशास्त्रातील मूलभूत सूत्रांचे संकलन
विद्यार्थ्याचे पॉकेट मार्गदर्शक
सामान्य रसायनशास्त्र
सर्वात महत्वाच्या रासायनिक संकल्पना आणि कायदे
रासायनिक घटक- हा समान परमाणु चार्ज असलेला एक विशिष्ट प्रकारचा अणू आहे.
सापेक्ष अणु वस्तुमान(A r) दिलेल्या रासायनिक घटकाच्या अणूचे वस्तुमान कार्बन-12 अणू (12 C) च्या वस्तुमानापेक्षा किती पटीने जास्त आहे हे दाखवते.
रासायनिक पदार्थ- कोणत्याही रासायनिक कणांचा संग्रह.
रासायनिक कण
सूत्र युनिट- एक पारंपारिक कण, ज्याची रचना दिलेल्या रासायनिक सूत्राशी संबंधित आहे, उदाहरणार्थ:एआर - आर्गॉन पदार्थ (एआर अणूंचा समावेश आहे),
H 2 O - पदार्थाचे पाणी (H 2 O रेणू असतात),
KNO 3 - पोटॅशियम नायट्रेट पदार्थ (K + cations आणि NO 3 ¯ anions असतात).
भौतिक प्रमाणांमधील संबंध
घटकाचे अणु वस्तुमान (सापेक्ष). B, A r (B):कुठे *ट(अणू बी) - बी घटकाच्या अणूचे वस्तुमान;
*t आणि- अणु वस्तुमान युनिट;
*t आणि = 1/12 ट(12 C अणू) = 1.6610 24 ग्रॅम.
पदार्थाचे प्रमाण B, n(B), mol:
कुठे N(B)- कण बी संख्या;
एन ए- ॲव्होगाड्रोचे स्थिरांक (N A = 6.0210 23 mol -1).
पदार्थाचे मोलर वस्तुमान V, M(V), g/mol:
कुठे t(V)- वस्तुमान बी.
वायूचे मोलर व्हॉल्यूममध्ये, व्ही एम l/mol:
कुठे V M = 22.4 l/mol (Avogadro च्या नियमाचा परिणाम), सामान्य परिस्थितीत (n.s. - वातावरणाचा दाब p = 101,325 Pa (1 atm); थर्मोडायनामिक तापमान टी = 273.15 के किंवा सेल्सिअस तापमान t = 0 °C).
बी हायड्रोजनसाठी, डी(गॅस बी बाय एच २):
*वायू पदार्थाची घनता IN हवाई मार्गाने, डी(वायू ओव्हर बी): घटकाचा वस्तुमान अंशइ पदार्थात V, w(E):जेथे x हा पदार्थ B च्या सूत्रातील E अणूंची संख्या आहे
अणूची रचना आणि नियतकालिक कायदा D.I. मेंडेलीव्ह
वस्तुमान संख्या (A) - अणु केंद्रकातील प्रोटॉन आणि न्यूट्रॉनची एकूण संख्या:
A = N(p 0) + N(p +).
आण्विक आण्विक शुल्क (Z)न्यूक्लियसमधील प्रोटॉनची संख्या आणि अणूमधील इलेक्ट्रॉनच्या संख्येइतकी:Z = N(p+) = N(e¯).
समस्थानिक- समान घटकाचे अणू, न्यूक्लियसमधील न्यूट्रॉनच्या संख्येत भिन्न, उदाहरणार्थ: पोटॅशियम-39: 39 के (19 p + , 20n 0, 19e¯); पोटॅशियम -40: 40 के (19 p+, 21n 0, 19e¯).*ऊर्जा पातळी आणि उपपातळी
*अणु कक्षा(AO) स्पेसचा प्रदेश दर्शवतो ज्यामध्ये इलेक्ट्रॉनची विशिष्ट ऊर्जा असण्याची शक्यता सर्वात जास्त असते.*s- आणि p-ऑर्बिटल्सचे आकार
नियतकालिक कायदा आणि नियतकालिक प्रणाली D.I. मेंडेलीव्ह
घटकांचे गुणधर्म आणि त्यांची संयुगे अधूनमधून वाढत्या अणुसंख्येसह पुनरावृत्ती करतात, जी घटकाच्या अणूच्या केंद्रकाच्या शुल्काप्रमाणे असते.कालावधी क्रमांकअनुरूप आहे इलेक्ट्रॉनांनी भरलेल्या ऊर्जा पातळीची संख्या,आणि याचा अर्थ आहे भरण्याची शेवटची ऊर्जा पातळी(EU).
गट क्रमांक एदाखवते आणि इ.
गट क्रमांक बीदाखवते व्हॅलेन्स इलेक्ट्रॉन्सची संख्या nsआणि (n – 1)d.
एस घटक विभाग- ऊर्जा सबलेव्हल (ESL) इलेक्ट्रॉनने भरलेले आहे ns-EPU– IA- आणि IIA-गट, H आणि He.
पी घटक विभाग- इलेक्ट्रॉनने भरलेले np-EPU– IIIA-VIIIA-गट.
डी घटक विभाग- इलेक्ट्रॉनने भरलेले (पी- 1) d-EPU – IB-VIIIB2-गट.
f- घटक विभाग- इलेक्ट्रॉनने भरलेले (पी-2) f-EPU - lanthanides आणि actinides.
आवर्त सारणीच्या 3 रा कालावधीतील घटकांच्या हायड्रोजन संयुगांच्या रचना आणि गुणधर्मांमधील बदल
अस्थिर, पाण्याने विघटित होते: NaH, MgH 2, AlH 3.अस्थिर: SiH 4, PH 3, H 2 S, HCl.
आवर्त सारणीच्या 3 रा कालावधीतील घटकांच्या उच्च ऑक्साइड आणि हायड्रॉक्साईड्सच्या रचना आणि गुणधर्मांमधील बदल
मूलभूत: Na 2 O – NaOH, MgO – Mg(OH) 2.एम्फोटेरिक:अल २ ओ ३ – अल(ओएच) ३.
अम्लीय: SiO 2 – H 4 SiO 4, P 2 O 5 – H 3 PO 4, SO 3 – H 2 SO 4, Cl 2 O 7 – HClO 4.
रासायनिक बंध
विद्युत ऋणात्मकता(χ) हे एक प्रमाण आहे जे रेणूमधील अणूची ऋण चार्ज घेण्याची क्षमता दर्शवते.सहसंयोजक बंध निर्मितीची यंत्रणा
एक्सचेंज यंत्रणा- शेजारच्या अणूंच्या दोन ऑर्बिटल्सचा ओव्हरलॅप, ज्यापैकी प्रत्येकामध्ये एक इलेक्ट्रॉन होता.दाता-स्वीकारणारी यंत्रणा- एका अणूच्या मुक्त परिभ्रमणाचा दुसऱ्या अणूच्या ऑर्बिटलसह ओव्हरलॅप ज्यामध्ये इलेक्ट्रॉनची जोडी असते.
बाँड निर्मिती दरम्यान ऑर्बिटल्सचा ओव्हरलॅप
*संकरीकरणाचा प्रकार – कणाचा भौमितिक आकार – बंधांमधील कोन
केंद्रीय अणू ऑर्बिटल्सचे संकरीकरण- त्यांची ऊर्जा आणि फॉर्म यांचे संरेखन.sp- रेखीय - 180°
sp 2- त्रिकोणी - 120°
sp 3- टेट्राहेड्रल - 109.5°
sp 3 ड- त्रिकोणीय-बायपिरामिडल - 90°; 120°
sp 3 d 2- अष्टधातु - 90°
मिश्रण आणि उपाय
उपाय- दोन किंवा अधिक पदार्थांचा समावेश असलेली एकसंध प्रणाली, ज्याची सामग्री विशिष्ट मर्यादेत बदलू शकते.
उपाय:विद्राव्य (उदा. पाणी) + विद्राव्य.
खरे उपाय 1 नॅनोमीटरपेक्षा लहान कण असतात.
कोलोइडल सोल्यूशन्स 1 ते 100 नॅनोमीटर आकाराचे कण असतात.
यांत्रिक मिश्रणे(निलंबन) मध्ये 100 नॅनोमीटरपेक्षा मोठे कण असतात.
निलंबन=> घन + द्रव
इमल्शन=> द्रव + द्रव
फेस, धुके=> वायू + द्रव
विषम मिश्रण वेगळे केले जातातसेटलिंग आणि फिल्टरिंग.
एकसंध मिश्रण वेगळे केले जातातबाष्पीभवन, ऊर्धपातन, क्रोमॅटोग्राफी.
संतृप्त समाधानद्रावणाशी समतोल आहे किंवा असू शकतो (जर विद्राव्य घन असेल, तर त्याचा जादा भाग अवक्षेपात असेल).
विद्राव्यता- दिलेल्या तापमानात संतृप्त द्रावणात विरघळलेल्या पदार्थाची सामग्री.
असंतृप्त समाधान कमी,
सुपरसॅच्युरेटेड सोल्यूशनद्रावण समाविष्टीत आहे अधिक,दिलेल्या तापमानात त्याच्या विद्राव्यतेपेक्षा.
द्रावणातील भौतिक-रासायनिक प्रमाणांमधील संबंध
द्रावणाचा वस्तुमान अंशमध्ये, w(B);युनिटचा अंश किंवा %:कुठे t(V)- वस्तुमान बी,
t(r)- द्रावणाचे वस्तुमान.
द्रावणाचे वजन, m(p), g:
m(p) = m(B) + m(H 2 O) = V(p) ρ(p),
जेथे F(p) हा द्रावणाचा आवाज आहे;ρ(p) - द्रावण घनता.
सोल्यूशनचे प्रमाण, V(p), l:
मोलर एकाग्रता, s(V), mol/l:जेथे n(B) हे पदार्थ B चे प्रमाण आहे;
M(B) - पदार्थ B चे मोलर वस्तुमान.
सोल्यूशनची रचना बदलणे
पाण्याने द्रावण पातळ करणे:> t"(V)= t(B);
> द्रावणाचे वस्तुमान जोडलेल्या पाण्याच्या वस्तुमानाने वाढते: m"(p) = m(p) + m(H 2 O).
द्रावणातून पाण्याचे बाष्पीभवन करणे:
> द्रावणाचे वस्तुमान बदलत नाही: t"(B) = t(B).
> द्रावणाचे वस्तुमान बाष्पीभवन झालेल्या पाण्याच्या वस्तुमानाने कमी होते: m"(p) = m(p) - m(H 2 O).
दोन उपाय एकत्र करणे:द्रावणांचे वस्तुमान, तसेच विरघळलेल्या पदार्थाचे वस्तुमान, जोडतात:
t"(B) = t(B) + t"(B);
t"(p) = t(p) + t"(p).
क्रिस्टल ड्रॉप:द्रावणाचे वस्तुमान आणि द्रावणाचे वस्तुमान प्रक्षेपित क्रिस्टल्सच्या वस्तुमानाने कमी होते:
m"(B) = m(B) - m(गाळ); m"(p) = m(p) - m(गाळ).
पाण्याचे वस्तुमान बदलत नाही.
रासायनिक अभिक्रियाचा थर्मल प्रभाव
*पदार्थाच्या निर्मितीची एन्थाल्पी ΔH°(B), kJ/mol, साध्या पदार्थापासून पदार्थाच्या 1 मोल तयार होण्याच्या प्रतिक्रियेची एंथॅल्पी आहे त्यांच्या मानक स्थितींमध्ये, म्हणजे, स्थिर दाबाने (प्रत्येक वायूसाठी 1 एटीएम किंवा एकूण वायू प्रतिक्रिया सहभागींच्या अनुपस्थितीत 1 atm चा दाब) आणि स्थिर तापमान (सामान्यतः 298 K , किंवा 25 °C).*रासायनिक अभिक्रियाचा थर्मल इफेक्ट (हेसचा नियम)
Q = ΣQ(उत्पादने) - ΣQ(अभिकर्मक).
ΔН° = ΣΔН°(उत्पादने) - Σ ΔН°(अभिकर्मक).
प्रतिक्रियेसाठी aA + bB +… = dD + eE +…ΔH° = (dΔH°(D) + eΔH°(E) +…) – (aΔH°(A) + bΔH°(B) +…),
कुठे a, b, d, e- प्रतिक्रिया समीकरणातील गुणांकांशी संबंधित पदार्थांचे स्टोचिओमेट्रिक प्रमाण.रासायनिक प्रतिक्रिया दर
जर वेळेत τ व्हॉल्यूममध्ये व्हीरिॲक्टंट किंवा उत्पादनाचे प्रमाण Δ ने बदलले आहे n,गती प्रतिक्रिया:
मोनोमोलेक्युलर प्रतिक्रिया A →… साठी:
v = k c(A).
द्विमोलेक्युलर प्रतिक्रिया A + B → साठी ...:v = k c(A) c(B).
A + B + C → त्रिमोलीक्युलर अभिक्रियासाठी ...:v = k c(A) c(B) c(C).
रासायनिक अभिक्रियाचा दर बदलणे
गती प्रतिक्रिया वाढवा:1) रासायनिक सक्रियअभिकर्मक;
2) जाहिरातअभिकर्मक एकाग्रता;
3) वाढ
4) जाहिराततापमान;
5) उत्प्रेरकगती प्रतिक्रिया कमी करा:
1) रासायनिक निष्क्रियअभिकर्मक;
2) पदावनतीअभिकर्मक एकाग्रता;
3) कमीघन आणि द्रव अभिकर्मकांच्या पृष्ठभाग;
4) पदावनतीतापमान;
5) अवरोधक
*तापमान गती गुणांक(γ) तापमान दहा अंशांनी वाढते तेव्हा प्रतिक्रियेचा दर किती वेळा वाढतो हे दर्शविणाऱ्या संख्येच्या समान आहे:
रासायनिक समतोल
*रासायनिक समतोलासाठी वस्तुमान कृतीचा कायदा:समतोल स्थितीत, समान शक्तींमध्ये उत्पादनांच्या दाढ सांद्रतेच्या उत्पादनाचे गुणोत्तर
त्यांचे स्टॉइचियोमेट्रिक गुणांक, स्थिर तापमानात, त्यांच्या स्टोचिओमेट्रिक गुणांकांच्या समान शक्तींमधील अभिक्रियाकांच्या दाढ सांद्रतेच्या उत्पादनापर्यंत, स्थिर मूल्य आहे (एकाग्रता समतोल स्थिर).
उलट करता येण्याजोग्या प्रतिक्रियेसाठी रासायनिक समतोल स्थितीत:
aA + bB + … ↔ dD + fF + …
K c = [D] d [F] f .../ [A] a [B] b ...
*उत्पादनांच्या निर्मितीकडे रासायनिक समतोल बदलणे
1) अभिकर्मकांची एकाग्रता वाढवणे;2) उत्पादनांची एकाग्रता कमी करणे;
3) तापमानात वाढ (एंडोथर्मिक प्रतिक्रियासाठी);
4) तापमानात घट (एक्झॉथर्मिक प्रतिक्रियासाठी);
5) दाब वाढणे (व्हॉल्यूम कमी झाल्यामुळे होणाऱ्या प्रतिक्रियेसाठी);
6) दाब कमी होणे (व्हॉल्यूम वाढल्याने होणाऱ्या प्रतिक्रियेसाठी).
सोल्युशनमध्ये प्रतिक्रियांची देवाणघेवाण करा
इलेक्ट्रोलाइटिक पृथक्करण- जेव्हा काही पदार्थ पाण्यात विरघळतात तेव्हा आयन (केशन आणि आयन) तयार होण्याची प्रक्रिया.
ऍसिडस्तयार होतात हायड्रोजन केशनआणि ऍसिड anions,उदाहरणार्थ:
HNO 3 = H + + NO 3 ¯
इलेक्ट्रोलाइटिक पृथक्करण दरम्यान कारणेतयार होतात धातू केशनआणि हायड्रॉक्साइड आयन, उदाहरणार्थ:NaOH = Na + + OH¯
इलेक्ट्रोलाइटिक पृथक्करण दरम्यान क्षार(मध्यम, दुहेरी, मिश्र) तयार होतात धातू केशनआणि ऍसिड आयन, उदाहरणार्थ:NaNO 3 = Na + + NO 3 ¯
KAl(SO 4) 2 = K + + Al 3+ + 2SO 4 2-
इलेक्ट्रोलाइटिक पृथक्करण दरम्यान आम्ल ग्लायकोकॉलेटतयार होतात धातू केशनआणि ऍसिड हायड्रोएनियन्स, उदाहरणार्थ:NaHCO 3 = Na + + HCO 3 ‾
काही मजबूत ऍसिडस्
HBr, HCl, HClO 4, H 2 Cr 2 O 7, HI, HMnO 4, H 2 SO 4, H 2 SeO 4, HNO 3, H 2 CrO 4काही भक्कम कारणे
RbOH, CsOH, KOH, NaOH, LiOH, Ba(OH) 2, Sr(OH) 2, Ca(OH) 2पृथक्करण पदवी α- विभक्त कणांच्या संख्येचे प्रारंभिक कणांच्या संख्येचे गुणोत्तर.
स्थिर व्हॉल्यूमवर:
पृथक्करणाच्या डिग्रीनुसार पदार्थांचे वर्गीकरण
बर्थोलेटचा नियम
द्रावणातील एक्सचेंज प्रतिक्रिया अपरिवर्तनीयपणे पुढे जातील जर परिणाम म्हणजे अवक्षेपण, वायू किंवा कमकुवत इलेक्ट्रोलाइटची निर्मिती.आण्विक आणि आयनिक प्रतिक्रिया समीकरणांची उदाहरणे
1. आण्विक समीकरण: CuCl 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaCl“पूर्ण” आयनिक समीकरण: Сu 2+ + 2Сl¯ + 2Na + + 2OH¯ = Cu(OH) 2 ↓ + 2Na + + 2Сl¯
"लहान" आयनिक समीकरण: Cu 2+ + 2OH¯ = Cu(OH) 2 ↓
2. आण्विक समीकरण: FeS (T) + 2HCl = FeCl 2 + H 2 S
“पूर्ण” आयनिक समीकरण: FeS + 2H + + 2Сl¯ = Fe 2+ + 2Сl¯ + H 2 S
"लहान" आयनिक समीकरण: FeS (T) + 2H + = Fe 2+ + H 2 S
3. आण्विक समीकरण: 3HNO 3 + K 3 PO 4 = H 3 PO 4 + 3KNO 3
“पूर्ण” आयनिक समीकरण: 3H + + 3NO 3 ¯ + 3K + + PO 4 3- = H 3 PO 4 + 3K + + 3NO 3 ¯
"लहान" आयनिक समीकरण: 3H + + PO 4 3- = H 3 PO 4
*हायड्रोजन मूल्य
(pH) pH = – लॉग = 14 + लॉग*पातळ जलीय द्रावणासाठी PH श्रेणी
pH 7 (तटस्थ वातावरण)एक्सचेंज प्रतिक्रियांची उदाहरणे
तटस्थीकरण प्रतिक्रिया- ऍसिड आणि बेस परस्परसंवाद करताना उद्भवणारी एक्सचेंज प्रतिक्रिया.1. अल्कली + मजबूत आम्ल: Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
बा 2+ + 2OH¯ + 2H + + 2Сl¯ = Ba 2+ + 2Сl¯ + 2Н 2 O
H + + OH¯ = H 2 O
2. किंचित विरघळणारा आधार + मजबूत आम्ल: Cu(OH) 2(t) + 2HCl = CuCl 2 + 2H 2 O
Cu(OH) 2 + 2H + + 2Cl¯ = Cu 2+ + 2Cl¯ + 2H 2 O
Cu(OH) 2 + 2H + = Cu 2+ + 2H 2 O
* हायड्रोलिसिस- अणूंच्या ऑक्सिडेशन अवस्था न बदलता पदार्थ आणि पाणी यांच्यातील विनिमय प्रतिक्रिया.
1. बायनरी संयुगांचे अपरिवर्तनीय हायड्रोलिसिस:
Mg 3 N 2 + 6H 2 O = 3Mg(OH) 2 + 2NH 3
2. क्षारांचे उलट करता येणारे हायड्रोलिसिस:
अ) मीठ तयार होते मजबूत बेस कॅशन आणि मजबूत ऍसिड आयन:
NaCl = Na + + Сl¯
Na + + H 2 O ≠ ;
Cl¯ + H 2 O ≠
हायड्रोलिसिस नाही; तटस्थ वातावरण, pH = 7.
ब) मीठ तयार होते मजबूत बेस कॅशन आणि कमकुवत ऍसिड आयन:
Na 2 S = 2Na + + S 2-
Na + + H 2 O ≠
S 2- + H 2 O ↔ HS¯ + OH¯
आयनॉनद्वारे हायड्रोलिसिस; अल्कधर्मी वातावरण, pH >7.
ब) मीठ तयार होते कमकुवत किंवा किंचित विरघळणाऱ्या पायाचे केशन आणि मजबूत आम्लाचे आयन:
परिचयात्मक भागाचा शेवट.
लिटर एलएलसी द्वारे प्रदान केलेला मजकूर.
तुम्ही पुस्तकासाठी Visa, MasterCard, Maestro बँक कार्ड, मोबाइल फोन खात्यावरून, पेमेंट टर्मिनलवरून, MTS किंवा Svyaznoy स्टोअरमध्ये, PayPal, WebMoney, Yandex.Money, QIWI वॉलेट, बोनस कार्डद्वारे सुरक्षितपणे पैसे देऊ शकता. आपल्यासाठी सोयीस्कर दुसरी पद्धत.
माहिती तपासा. या लेखात सादर केलेल्या माहितीची सत्यता आणि विश्वासार्हता तपासणे आवश्यक आहे. चर्चा पानावर या विषयावर चर्चा आहे: शब्दावलीबाबत शंका. रासायनिक सूत्र... विकिपीडिया
रासायनिक सूत्र रासायनिक चिन्हे, संख्या आणि कंसाचे विभाजन करणारे चिन्ह वापरून पदार्थांच्या रचना आणि संरचनेबद्दल माहिती प्रतिबिंबित करते. सध्या, खालील प्रकारचे रासायनिक सूत्र वेगळे केले जातात: सर्वात सोपा सूत्र. अनुभवींकडून मिळू शकते... ... विकिपीडिया
रासायनिक सूत्र रासायनिक चिन्हे, संख्या आणि कंसाचे विभाजन करणारे चिन्ह वापरून पदार्थांच्या रचना आणि संरचनेबद्दल माहिती प्रतिबिंबित करते. सध्या, खालील प्रकारचे रासायनिक सूत्र वेगळे केले जातात: सर्वात सोपा सूत्र. अनुभवींकडून मिळू शकते... ... विकिपीडिया
रासायनिक सूत्र रासायनिक चिन्हे, संख्या आणि कंसाचे विभाजन करणारे चिन्ह वापरून पदार्थांच्या रचना आणि संरचनेबद्दल माहिती प्रतिबिंबित करते. सध्या, खालील प्रकारचे रासायनिक सूत्र वेगळे केले जातात: सर्वात सोपा सूत्र. अनुभवींकडून मिळू शकते... ... विकिपीडिया
रासायनिक सूत्र रासायनिक चिन्हे, संख्या आणि कंसाचे विभाजन करणारे चिन्ह वापरून पदार्थांच्या रचना आणि संरचनेबद्दल माहिती प्रतिबिंबित करते. सध्या, खालील प्रकारचे रासायनिक सूत्र वेगळे केले जातात: सर्वात सोपा सूत्र. अनुभवींकडून मिळू शकते... ... विकिपीडिया
मुख्य लेख: अजैविक संयुगे घटकांनुसार अजैविक संयुगांची यादी प्रत्येक पदार्थासाठी वर्णक्रमानुसार (सूत्रानुसार) सादर केलेल्या अजैविक संयुगांची माहितीपूर्ण यादी, घटकांचे हायड्रोजन ऍसिड (जर ... ... विकिपीडिया
या लेखाची किंवा विभागाची पुनरावृत्ती आवश्यक आहे. कृपया लेख लिहिण्याच्या नियमांनुसार लेखात सुधारणा करा... विकिपीडिया
रासायनिक समीकरण (रासायनिक अभिक्रियेचे समीकरण) हे रासायनिक सूत्र, संख्यात्मक गुणांक आणि गणितीय चिन्हे वापरून रासायनिक अभिक्रियाचे पारंपारिक प्रतिनिधित्व आहे. रासायनिक अभिक्रियाचे समीकरण गुणात्मक आणि परिमाणवाचक देते... ... विकिपीडिया
रासायनिक सॉफ्टवेअर हे रसायनशास्त्राच्या क्षेत्रात वापरले जाणारे संगणक प्रोग्राम आहेत. सामग्री 1 रासायनिक संपादक 2 प्लॅटफॉर्म 3 साहित्य ... विकिपीडिया
पुस्तके
- औद्योगिक उपकरणांच्या स्थापनेसाठी जपानी-इंग्रजी-रशियन शब्दकोश. सुमारे 8,000 अटी, Popova I.S. हा शब्दकोश वापरकर्त्यांच्या विस्तृत श्रेणीसाठी आणि मुख्यतः जपानमधील औद्योगिक उपकरणांच्या पुरवठा आणि अंमलबजावणीमध्ये गुंतलेल्या अनुवादकांसाठी आणि तांत्रिक तज्ञांसाठी आहे.
- जैवरासायनिक संज्ञांचा एक संक्षिप्त शब्दकोश, कुनिझेव्ह एस.एम. हा शब्दकोश सामान्य बायोकेमिस्ट्री, इकोलॉजी आणि बायोटेक्नॉलॉजीच्या मूलभूत गोष्टींचा अभ्यासक्रम शिकत असलेल्या विद्यापीठांमधील रासायनिक आणि जैविक वैशिष्ट्यांच्या विद्यार्थ्यांसाठी आहे आणि त्यात देखील वापरला जाऊ शकतो ...
अनेक मूलभूत संकल्पना आणि सूत्रे.
सर्व पदार्थांचे वस्तुमान, घनता आणि खंड वेगवेगळे असतात. एका घटकातील धातूचा तुकडा दुसऱ्या धातूच्या अगदी समान आकाराच्या तुकड्यापेक्षा कितीतरी पटीने जास्त वजनाचा असू शकतो.
तीळ(मोल्सची संख्या)
पदनाम: तीळ, आंतरराष्ट्रीय: मोल- पदार्थाच्या प्रमाणात मोजण्याचे एकक. समाविष्ट असलेल्या पदार्थाच्या प्रमाणाशी संबंधित आहे एन.ए.कण (रेणू, अणू, आयन) म्हणून, एक सार्वत्रिक प्रमाण सादर केले गेले - moles संख्या.टास्कमध्ये वारंवार आढळणारा एक वाक्प्रचार म्हणजे "प्राप्त... पदार्थाचा तीळ"
एन.ए.= ६.०२ १०२३
एन.ए.- एव्होगाड्रोचा क्रमांक. तसेच “करारानुसार संख्या.” पेन्सिलच्या टोकामध्ये किती अणू असतात? सुमारे एक हजार. अशा प्रमाणात काम करणे सोयीचे नाही. म्हणून, जगभरातील रसायनशास्त्रज्ञ आणि भौतिकशास्त्रज्ञांनी सहमती दर्शविली - चला 6.02 × 1023 कण (अणू, रेणू, आयन) म्हणून नियुक्त करूया. 1 तीळ पदार्थ.
1 तीळ = 6.02 1023 कण
समस्या सोडवण्याच्या मूलभूत सूत्रांपैकी हे पहिले होते.
पदार्थाचे मोलर वस्तुमान
मोलर मासपदार्थ म्हणजे एकाचे वस्तुमान पदार्थाचा तीळ.
श्री म्हणून दर्शविले. हे नियतकालिक सारणीनुसार आढळते - हे फक्त पदार्थाच्या अणू वस्तुमानाची बेरीज आहे.
उदाहरणार्थ, आम्हाला सल्फ्यूरिक ऍसिड - H2SO4 दिले जाते. चला पदार्थाच्या मोलर वस्तुमानाची गणना करूया: अणू वस्तुमान H = 1, S-32, O-16.
Mr(H2SO4)=1 2+32+16 4=98 g\mol.
समस्या सोडवण्यासाठी दुसरे आवश्यक सूत्र आहे
पदार्थ वस्तुमान सूत्र:
म्हणजेच, एखाद्या पदार्थाचे वस्तुमान शोधण्यासाठी, आपल्याला मोल (n) ची संख्या माहित असणे आवश्यक आहे आणि आवर्त सारणीवरून आपल्याला मोलर वस्तुमान सापडतो.
वस्तुमानाच्या संवर्धनाचा कायदा -रासायनिक अभिक्रियामध्ये प्रवेश करणार्या पदार्थांचे वस्तुमान नेहमीच परिणामी पदार्थांच्या वस्तुमानाच्या समान असते.
प्रतिक्रिया देणाऱ्या पदार्थांचे वस्तुमान (es) आपल्याला माहीत असल्यास, त्या प्रतिक्रियेच्या उत्पादनांचे वस्तुमान (es) आपण शोधू शकतो. आणि उलट.
रसायनशास्त्रातील समस्या सोडवण्याचे तिसरे सूत्र आहे
पदार्थाचे प्रमाण:
क्षमस्व, ही प्रतिमा आमच्या मार्गदर्शक तत्त्वांची पूर्तता करत नाही. प्रकाशन सुरू ठेवण्यासाठी, कृपया प्रतिमा हटवा किंवा दुसरी अपलोड करा.22.4 क्रमांक कुठून आला? पासून एव्होगाड्रोचा कायदा:
समान तापमान आणि दाबाने घेतलेल्या वेगवेगळ्या वायूंच्या समान खंडांमध्ये समान संख्येचे रेणू असतात.
ॲव्होगाड्रोच्या नियमानुसार, सामान्य परिस्थितीत (एन.एस.) आदर्श वायूच्या 1 मोलची मात्रा समान असते. Vm= 22.413 996(39) l
म्हणजेच, जर समस्येमध्ये आपल्याला सामान्य परिस्थिती दिली गेली असेल तर, मोल (n) ची संख्या जाणून घेतल्यास, आपण पदार्थाचे प्रमाण शोधू शकतो.
तर, समस्या सोडवण्यासाठी मूलभूत सूत्रेरसायनशास्त्र मध्ये
Avogadro चा नंबरएन.ए.
6.02 1023 कण
पदार्थाचे प्रमाण n (mol)
n=V\22.4 (l\mol)
पदार्थाचे वस्तुमान m (g)
पदार्थाची मात्रा V(l)
V=n 22.4 (l\mol)
क्षमस्व, ही प्रतिमा आमच्या मार्गदर्शक तत्त्वांची पूर्तता करत नाही. प्रकाशन सुरू ठेवण्यासाठी, कृपया प्रतिमा हटवा किंवा दुसरी अपलोड करा.ही सूत्रे आहेत. बऱ्याचदा, समस्यांचे निराकरण करण्यासाठी, आपल्याला प्रथम प्रतिक्रिया समीकरण लिहिणे आवश्यक आहे आणि (आवश्यक!) गुणांकांची मांडणी करणे आवश्यक आहे - त्यांचे गुणोत्तर प्रक्रियेतील मोल्सचे गुणोत्तर निर्धारित करते.
मुख्य शब्द: रसायनशास्त्र 8 वी इयत्ता. सर्व सूत्रे आणि व्याख्या, भौतिक प्रमाणांची चिन्हे, मापनाची एकके, मोजमापाची एकके निश्चित करण्यासाठी उपसर्ग, एककांमधील संबंध, रासायनिक सूत्रे, मूलभूत व्याख्या, थोडक्यात, सारण्या, आकृत्या.
1. मापनाची चिन्हे, नावे आणि एकके
रसायनशास्त्रात वापरलेले काही भौतिक प्रमाण
| भौतिक प्रमाण | पदनाम | युनिट |
| वेळ | ट | B= |
| दाब | p | Pa, kPa |
| पदार्थाचे प्रमाण | ν | तीळ |
| पदार्थाचे वस्तुमान | मी | kg, g |
| वस्तुमान अपूर्णांक | ω | आकारहीन |
| मोलर मास | एम | kg/mol, g/mol |
| मोलर व्हॉल्यूम | व्ही.एन | m 3 /mol, l/mol |
| पदार्थाचे प्रमाण | व्ही | मी 3, l |
| खंड अपूर्णांक | आकारहीन | |
| सापेक्ष अणु वस्तुमान | एक आर | आकारहीन |
| श्री | आकारहीन | |
| गॅस ए ते गॅस बी ची सापेक्ष घनता | डी B (A) | आकारहीन |
| पदार्थाची घनता | आर | kg/m 3, g/cm 3, g/ml |
| एव्होगाड्रोचे स्थिर | एन ए | 1/mol |
| परिपूर्ण तापमान | ट | के (केल्विन) |
| सेल्सिअस मध्ये तापमान | ट | °C (अंश सेल्सिअस) |
| रासायनिक अभिक्रियाचा थर्मल प्रभाव | प्र | kJ/mol |

2. भौतिक प्रमाणांच्या एककांमधील संबंध

3. 8 व्या वर्गात रासायनिक सूत्रे
4. 8 व्या वर्गात मूलभूत व्याख्या

- अणू- पदार्थाचा सर्वात लहान रासायनिकदृष्ट्या अविभाज्य कण.
- रासायनिक घटक- एक विशिष्ट प्रकारचा अणू.
- रेणू- पदार्थाचा सर्वात लहान कण जो त्याची रचना आणि रासायनिक गुणधर्म टिकवून ठेवतो आणि त्यात अणू असतात.
- साधे पदार्थ- पदार्थ ज्यांच्या रेणूंमध्ये समान प्रकारचे अणू असतात.
- जटिल पदार्थ- पदार्थ ज्यांच्या रेणूंमध्ये विविध प्रकारचे अणू असतात.
- पदार्थाची गुणात्मक रचना त्यात कोणत्या घटकांचे अणू आहेत ते दाखवते.
- पदार्थाची परिमाणात्मक रचना त्याच्या रचनेतील प्रत्येक घटकाच्या अणूंची संख्या दाखवते.
- रासायनिक सूत्र- रासायनिक चिन्हे आणि निर्देशांक वापरून पदार्थाच्या गुणात्मक आणि परिमाणवाचक रचनेचे पारंपारिक रेकॉर्डिंग.
- अणु वस्तुमान एकक(amu) - अणू वस्तुमान मोजण्याचे एकक, कार्बन अणूच्या 1/12 च्या वस्तुमान 12 सी.
- तीळ- 0.012 किलो कार्बन 12 सी मध्ये अणूंच्या संख्येइतके कण असलेल्या पदार्थाचे प्रमाण.
- एव्होगाड्रोचे स्थिर (ना = 6*10 23 mol -1) - एका तीळमध्ये असलेल्या कणांची संख्या.
- पदार्थाचे मोलर वस्तुमान (हवेतील वायू पदार्थ X ची घनता ) हे 1 मोलच्या प्रमाणात घेतलेल्या पदार्थाचे वस्तुमान आहे.
- सापेक्ष अणु वस्तुमानघटक ए आर - दिलेल्या घटकाच्या अणूच्या वस्तुमानाचे गुणोत्तर m 0 ते कार्बन अणूच्या वस्तुमानाच्या 1/12 12 C.
- सापेक्ष आण्विक वजनपदार्थ हवेतील वायू पदार्थ X ची घनता आर - दिलेल्या पदार्थाच्या रेणूच्या वस्तुमानाचे गुणोत्तर कार्बन अणूच्या वस्तुमानाच्या 1/12 C. सापेक्ष आण्विक वस्तुमान हे संयुग तयार करणाऱ्या रासायनिक घटकांच्या सापेक्ष अणू वस्तुमानाच्या बेरजेइतके असते. दिलेल्या घटकाच्या अणूंची संख्या लक्षात घ्या.
- वस्तुमान अपूर्णांकरासायनिक घटक ω(X) X या पदार्थाच्या सापेक्ष आण्विक वस्तुमानाचा कोणता भाग दिलेल्या घटकाद्वारे दर्शविला जातो.
परमाणु-आण्विक शिक्षण
1. आण्विक आणि गैर-आण्विक रचना असलेले पदार्थ आहेत.
2. रेणूंमध्ये अंतर आहेत, ज्याचे आकार पदार्थ आणि तापमानाच्या एकत्रीकरणाच्या स्थितीवर अवलंबून असतात.
3. रेणू सतत गतीमध्ये असतात.
4. रेणू अणूंनी बनलेले असतात.
6. अणू विशिष्ट वस्तुमान आणि आकाराने दर्शविले जातात.
भौतिक घटना दरम्यान, रेणू संरक्षित केले जातात, रासायनिक घटना दरम्यान, ते नष्ट होतात. रासायनिक घटनांदरम्यान अणू पुनर्रचना करतात, नवीन पदार्थांचे रेणू तयार करतात.

पदार्थाच्या स्थिर रचनाचा कायदा
आण्विक संरचनेच्या प्रत्येक रासायनिकदृष्ट्या शुद्ध पदार्थाची, तयारीची पद्धत विचारात न घेता, स्थिर गुणात्मक आणि परिमाणात्मक रचना असते.
व्हॅलेन्स
व्हॅलेन्स हा रासायनिक घटकाच्या अणूचा गुणधर्म आहे जो दुसऱ्या घटकाच्या विशिष्ट संख्येच्या अणूंना जोडण्यासाठी किंवा बदलण्यासाठी असतो.

रासायनिक प्रतिक्रिया
रासायनिक प्रतिक्रिया ही एक घटना आहे ज्याच्या परिणामी एका पदार्थापासून इतर पदार्थ तयार होतात. अभिक्रिया करणारे पदार्थ रासायनिक अभिक्रियामध्ये प्रवेश करतात. प्रतिक्रिया उत्पादने प्रतिक्रिया परिणाम म्हणून तयार पदार्थ आहेत.
रासायनिक अभिक्रियाची चिन्हे:
1. उष्णता सोडणे (प्रकाश).
2. रंगात बदल.
3. दुर्गंधी दिसून येते.
4. गाळाची निर्मिती.
5. गॅस सोडणे.




 व्ही मी= 22.4 l/mol (n.s.)
व्ही मी= 22.4 l/mol (n.s.)