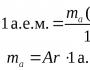مجموعة من الصيغ في الكيمياء. الصيغ الأساسية لحل المشاكل
|
حجمها وأبعادها |
نسبة |
|
الكتلة الذرية للعنصر X (نسبية) |
|
|
الرقم التسلسلي للعنصر |
ض= ن(ه –) = ن(ر +) |
|
الكسر الكتلي للعنصر E في المادة X، في كسور الوحدة، بالنسبة المئوية |
|
|
كمية المادة X، مول | |
|
كمية المادة الغازية، مول |
حسنًا. - ر= 101325 باسكال، ت= 273 ك |
|
الكتلة المولية للمادة X، جم/مول، كجم/مول |
|
|
كتلة المادة X، ز، كجم |
م(×) = ن(x) م(X) |
|
الحجم المولي للغاز، لتر/مول، م3 /مول |
الخامس م= 22.4 لتر/مول عند NS |
|
حجم الغاز، م 3 |
الخامس = الخامس م × ن |
|
عائد المنتج |
|
|
كثافة المادة X، جم/لتر، جم/مل، كجم/م3 |
|
|
كثافة المادة الغازية X بالهيدروجين |
|
|
كثافة المادة الغازية X في الهواء |
م(الهواء) = 29 جم/مول |
|
قانون الغاز المتحد |
|
|
معادلة مندليف-كلابيرون |
الكهروضوئية = العلاج ببدائل النيكوتين, ر= 8.314 جول/مول×ك |
|
الجزء الحجمي للمادة الغازية في خليط من الغازات، في أجزاء من الوحدة أو في النسبة المئوية |
|
|
الكتلة المولية لخليط من الغازات |
|
|
الكسر المولي للمادة (X) في الخليط |
|
|
كمية الحرارة J، كيلوجول |
س = ن(x) س(X) |
|
التأثير الحراري للتفاعل |
س = –ح |
|
حرارة تكوين المادة X، J/mol، kJ/mol |
|
|
معدل التفاعل الكيميائي (مول/لترثانية) |
|
|
قانون العمل الجماعي (للرد البسيط) |
أأ+ الخامسب= معج + دد ش = ك مع أ(أ) مع الخامس(ب) |
|
قاعدة فانت هوف |
|
|
ذوبان المادة (X) (جم/100 جم مذيب) |
|
|
الكسر الكتلي للمادة X في الخليط A + X، في كسور الوحدة، بالنسبة المئوية |
|
|
وزن المحلول، جم، كجم |
م(ص) = م(x)+ م(H2O) م(ص) = الخامس(ص) (ص) |
|
الكسر الكتلي للمادة المذابة في المحلول، بأجزاء من الوحدة، بالنسبة المئوية |
|
|
كثافة الحل |
|
|
حجم المحلول سم 3، لتر، م 3 |
|
|
التركيز المولي، مول/لتر |
|
|
درجة تفكك الإلكتروليت (X)، في أجزاء من الوحدة أو النسبة المئوية |
|
|
المنتج الأيوني للماء |
ك(H2O) = |
|
قيمه الحامضيه |
الرقم الهيدروجيني = – لتر |
رئيسي:
كوزنتسوفا إن.إي. وإلخ. كيمياء. الصف الثامن إلى الصف العاشر – م: فينتانا-غراف، 2005-2007.
كوزنتسوفا إن إي، ليتفينوفا تي إن، ليفكين إيه إن.الكيمياء. الصف الحادي عشر في جزئين 2005-2007.
إيجوروف أ.س.كيمياء. كتاب مدرسي جديد للتحضير للجامعات. روستوف ن / د: فينيكس، 2004.– 640 ص.
إيجوروف أ.س. الكيمياء: دورة حديثة للتحضير لامتحان الدولة الموحدة. روستوف غير متوفر: فينيكس، 2011. (2012) – 699 ص.
إيجوروف أ.س.دليل التعليمات الذاتية لحل المشكلات الكيميائية. – روستوف على نهر الدون: فينيكس، 2000. – 352 ص.
الكيمياء / دليل المعلم للمتقدمين للجامعات. روستوف-ن/د، فينيكس، 2005-536 ص.
خومشينكو جي.بي.، خومشينكو آي.جي.. مشاكل في الكيمياء للمتقدمين للجامعات. م: المدرسة العليا. 2007.–302ص.
إضافي:
فروبليفسكي أ.. مواد تعليمية وتدريبية للتحضير للاختبار المركزي في الكيمياء / A.I. فروبليفسكي – مينيسوتا: Unipress LLC، 2004. – 368 ص.
فروبليفسكي أ.. 1000 مسألة في الكيمياء مع سلاسل التحولات واختبارات التحكم لأطفال المدارس والمتقدمين – مينيسوتا: Unipress LLC، 2003. – 400 ص.
إيجوروف أ.س.. جميع أنواع المسائل الحسابية في الكيمياء للتحضير لامتحان الدولة الموحدة – روستوف ن/د: فينيكس، 2003. – 320 ص.
إيجوروف إيه إس، أمينوفا جي.كيه.. المهام والتمارين النموذجية للتحضير لامتحان الكيمياء. – روستوف ن/د: فينيكس، 2005. – 448 ص.
امتحان الدولة الموحدة 2007. الكيمياء. المواد التعليمية والتدريبية لإعداد الطلاب / FIPI - م: مركز الفكر، 2007. – 272 ص.
امتحان الدولة الموحدة 2011 كيمياء. المجموعة التعليمية والتدريبية إد. أ.أ. كافيرينا – م: التربية الوطنية، 2011.
الخيارات الحقيقية الوحيدة للمهام للتحضير لامتحان الدولة الموحدة. امتحان الدولة الموحدة 2007. الكيمياء / V.Yu. ميشينا، إن. ستريلنيكوفا. م.: مركز الاختبارات الفيدرالي، 2007.–151 ص.
كافيرينا أ.أ. البنك الأمثل للمهام لإعداد الطلاب. امتحان الدولة الموحدة 2012. الكيمياء. كتاب مدرسي./ أ.أ. كافيرينا، د. دوبروتين، يو.ن. ميدفيديف، م.ج. سناستينا – م: مركز الفكر، 2012. – 256 ص.
ليتفينوفا تي إن، فيسكوبوفا إن كيه، أزهيبا إل تي، سولوفيوفا إم في.. مهام الاختبار بالإضافة إلى اختبارات طلاب الدورات التحضيرية بالمراسلة لمدة 10 أشهر (التعليمات المنهجية). كراسنودار، 2004. – ص18 – 70.
ليتفينوفا تي.ن.. كيمياء. امتحان الدولة الموحدة 2011 اختبارات التدريب. روستوف ن / د: فينيكس، 2011.– 349 ص.
ليتفينوفا تي.ن.. كيمياء. اختبارات لامتحان الدولة الموحدة. روستوف ن / د.: فينيكس، 2012. - 284 ص.
ليتفينوفا تي.ن.. كيمياء. قوانين وخواص العناصر ومركباتها. روستوف ن / د.: فينيكس، 2012. - 156 ص.
ليتفينوفا تي.إن.، ميلنيكوفا إي.دي.، سولوفيوفا إم.في.., أزيبا إل تي، فيسكوبوفا إن كيه.الكيمياء في مهام المتقدمين للجامعات – م.: دار أونيكس للنشر ذ.م.م: دار النشر مير والتعليم ذ.م.م، 2009. – 832 ص.
مجمع تعليمي ومنهجي في الكيمياء لطلاب الطبقات الطبية والبيولوجية، أد. تي.إن. ليتفينوفا – كراسنودار.: جامعة كورسك، – 2008.
كيمياء. امتحان الدولة الموحدة 2008 اختبارات القبول، المساعدات التعليمية / إد. ف.ن. دورونكينا. – روستوف غير متوفر: الفيلق، 2008.– 271 ص.
قائمة المواقع المتخصصة في الكيمياء:
1. الحيميك. http:// شبكة الاتصالات العالمية. الحيميك. رو
2. الكيمياء للجميع. كتاب مرجعي إلكتروني لدورة الكيمياء كاملة.
http:// شبكة الاتصالات العالمية. إنفورميكا. رو/ نص/ قاعدة البيانات/ كيمياء/ يبدأ. لغة البرمجة
3. الكيمياء المدرسية - كتاب مرجعي. http:// شبكة الاتصالات العالمية. الكيمياء المدرسية. بواسطة. رو
4. مدرس كيمياء. http://www. chemistry.nm.ru
موارد الإنترنت
الحيميك. http:// شبكة الاتصالات العالمية. الحيميك. رو
الكيمياء للجميع. كتاب مرجعي إلكتروني لدورة الكيمياء كاملة.
http:// شبكة الاتصالات العالمية. إنفورميكا. رو/ نص/ قاعدة البيانات/ كيمياء/ يبدأ. لغة البرمجة
الكيمياء المدرسية - كتاب مرجعي. http:// شبكة الاتصالات العالمية. الكيمياء المدرسية. بواسطة. رو
http://www.classchem.narod.ru
مدرس كيمياء. http://www. chemistry.nm.ru
http://www.alleng.ru/edu/chem.htm- موارد الإنترنت التعليمية في الكيمياء
http://schoolchemistry.by.ru/- الكيمياء المدرسية . يتمتع هذا الموقع بفرصة إجراء اختبارات عبر الإنترنت حول موضوعات مختلفة، بالإضافة إلى الإصدارات التجريبية من اختبار الدولة الموحدة
الكيمياء والحياة – القرن الحادي والعشرون: مجلة العلوم الشعبية. http:// شبكة الاتصالات العالمية. hij. رو
مجموعة من الصيغ الأساسية لدورة الكيمياء المدرسية
مجموعة من الصيغ الأساسية لدورة الكيمياء المدرسية
جي بي لوجينوفا
ايلينا سافينكينا
E. V. Savinkina G. P. Loginova
مجموعة من الصيغ الأساسية في الكيمياء
دليل جيب الطالب
كيمياء عامة
أهم المفاهيم والقوانين الكيميائية
عنصر كيميائي- هذا نوع معين من الذرة بنفس الشحنة النووية.
الكتلة الذرية النسبية(A r) يوضح عدد المرات التي تكون فيها كتلة ذرة عنصر كيميائي معين أكبر من كتلة ذرة الكربون 12 (12 C).
مادة كيميائية– مجموعة من أي جزيئات كيميائية.
جزيئات كيميائية
وحدة الصيغة– جسيم تقليدي يتوافق تركيبه مع الصيغة الكيميائية المحددة، على سبيل المثال:Ar - مادة الأرجون (تتكون من ذرات Ar)،
H 2 O - مادة الماء (تتكون من جزيئات H 2 O)،
KNO 3 – مادة نترات البوتاسيوم (تتكون من كاتيونات K+ وأنيونات NO3¯).
العلاقات بين الكميات الفيزيائية
الكتلة الذرية (النسبية) للعنصرب، أ ص (ب):أين *ت(الذرة ب) – كتلة ذرة العنصر ب;
* ر و- وحدة كتلة ذرية؛
* ر و = 1/12 ت(ذرة 12 سي) = 1.6610 24 جم.
كمية المادةب، ن(ب)، مول:
أين ن(ب)- عدد الجسيمات B؛
ن أ- ثابت أفوجادرو ( ن أ = 6.0210 23 مول -1).
الكتلة المولية للمادة V، M(V)، جم/مول:
أين تلفزيون)- الكتلة ب.
الحجم المولي للغازفي، في ملتر / مول:
أين الخامس م = 22.4 لتر/مول (نتيجة لقانون أفوجادرو)، في الظروف العادية (ns. - الضغط الجوي ع = 101,325 باسكال (1 ضغط جوي)؛ درجة الحرارة الديناميكية الحرارية ت =درجة حرارة 273.15 كلفن أو مئوية ر = 0 درجة مئوية).
ب للهيدروجين، د(الغاز B بواسطة H2):
* كثافة المادة الغازيةفي جوا، د(الغاز B فوق الهواء): جزء الكتلة من العنصره في المسألةالخامس، ث (ه):حيث x هو عدد ذرات E في صيغة المادة B
هيكل الذرة والقانون الدوري D.I. مندليف
العدد الكتلي (أ) – العدد الإجمالي للبروتونات والنيوترونات في النواة الذرية:
أ = ن(ع 0) + ن(ع +).
الشحنة النووية الذرية (Z)يساوي عدد البروتونات في النواة وعدد الإلكترونات في الذرة:Z = N(p+) = N(e¯).
النظائر– ذرات العنصر نفسه تختلف في عدد النيوترونات في النواة، على سبيل المثال: البوتاسيوم-39: 39 كلفن (19) ع + ، 20ن 0, 19ه¯); بوتاسيوم-40: 40 كلفن (19 ع+، 21ن 0, 19هـ¯).* مستويات الطاقة والمستويات الفرعية
* المدار الذري(AO) يميز منطقة الفضاء التي يكون فيها احتمال وجود إلكترون له طاقة معينة هو الأكبر.* أشكال المدارات s و p
القانون الدوري والنظام الدوري D.I. مندليف
تتكرر خواص العناصر ومركباتها بشكل دوري مع زيادة العدد الذري الذي يساوي شحنة نواة ذرة العنصر.رقم الفترةيتوافق عدد مستويات الطاقة المليئة بالإلكترونات،ويقف ل آخر مستوى طاقة يجب ملؤه(الاتحاد الأوروبي).
رقم المجموعة أعروض و إلخ.
رقم المجموعة بعروض عدد إلكترونات التكافؤ nsو (ن – 1)د.
قسم العناصر S– المستوى الفرعي للطاقة (ESL) مملوء بالإلكترونات ns-EPU- مجموعات IA وIIA، H وHe.
قسم العناصر P- مليئة بالإلكترونات np-EPU– مجموعات IIIA-VIIIA.
د- قسم العناصر- مليئة بالإلكترونات (ف- 1) د-EPU – مجموعات IB-VIIIB2.
قسم العناصر f- مليئة بالإلكترونات (ص-2) f-EPU – اللانثانيدات والأكتينيدات.
التغييرات في تكوين وخصائص مركبات الهيدروجين لعناصر الفترة الثالثة من الجدول الدوري
غير متطايرة، تتحلل بالماء: NaH، MgH 2، AlH 3.المواد المتطايرة: SiH 4، PH 3، H 2 S، حمض الهيدروكلوريك.
التغيرات في تكوين وخصائص الأكاسيد والهيدروكسيدات الأعلى لعناصر الفترة الثالثة من الجدول الدوري
أساسي:نا 2 O - هيدروكسيد الصوديوم، أهداب الشوق - المغنيسيوم (OH) 2.مذبذب:آل 2 يا 3 - آل (يا) 3.
حمضية: SiO 2 – H 4 SiO 4، P 2 O 5 – H 3 PO 4، SO 3 – H 2 SO 4، Cl 2 O 7 – HClO 4.
الرابطة الكيميائية
كهرسلبية(χ) هي الكمية التي تميز قدرة الذرة في الجزيء على اكتساب شحنة سالبة.آليات تكوين الرابطة التساهمية
آلية الصرف- تداخل مدارين من الذرات المتجاورة، ولكل منها إلكترون واحد.آلية المانحين والمتقبلين- تداخل مدار حر لذرة مع مدار ذرة أخرى تحتوي على زوج من الإلكترونات.
تداخل المدارات أثناء تكوين الرابطة
*نوع التهجين – الشكل الهندسي للجسيم – الزاوية بين الروابط
تهجين مدارات الذرة المركزية- محاذاة طاقتهم وشكلهم.sp– خطي – 180 درجة
س 2– الثلاثي – 120 درجة
س 3– رباعي السطوح – 109.5 درجة
س 3 د- مثلثي ثنائي الهرم - 90 درجة؛ 120 درجة
س 3 د 2- ثماني السطوح - 90 درجة
الخلطات والحلول
حل- نظام متجانس يتكون من مادتين أو أكثر يمكن تغيير محتواه ضمن حدود معينة.
حل:مذيب (مثل الماء) + مذاب.
حلول حقيقيةتحتوي على جسيمات أصغر من 1 نانومتر.
المحاليل الغرويةتحتوي على جسيمات يتراوح حجمها من 1 إلى 100 نانومتر.
مخاليط ميكانيكية(المعلقات) تحتوي على جسيمات أكبر من 100 نانومتر.
تعليق=> صلب + سائل
مستحلب=> سائل + سائل
رغوة، ضباب=> غاز + سائل
يتم فصل المخاليط غير المتجانسةالتسوية والتصفية.
يتم فصل المخاليط المتجانسةالتبخر، التقطير، اللوني.
محلول مشبعيكون أو قد يكون في حالة توازن مع المذاب (إذا كان المذاب صلبًا، فإن فائضه يكون في الراسب).
الذوبان- محتوى المادة المذابة في محلول مشبع عند درجة حرارة معينة.
محلول غير مشبع أقل،
محلول مفرط التشبعيحتوي على المذاب أكثر،من ذوبانه عند درجة حرارة معينة.
العلاقات بين الكميات الفيزيائية والكيميائية في المحلول
جزء الكتلة من المذابفي، ث (ب)؛جزء من الوحدة أو٪:أين تلفزيون)- الكتلة ب،
ر (ص)– كتلة المحلول .
وزن الحل،م (ع)، ز:
م(ع) = م(ب) + م(ح2س) = الخامس(ع) ρ(ع)،
حيث F(p) هو حجم الحل؛ρ(ع) – كثافة المحلول.
حجم الحل، V(ع)،ل:
التركيز المولي،ق (الخامس)، مول / لتر:حيث n(B) هي كمية المادة B؛
M(B) – الكتلة المولية للمادة B.
تغيير تكوين الحل
تخفيف المحلول بالماء:> تلفزيون)= ر(ب);
> تزداد كتلة المحلول بزيادة كتلة الماء المضاف: م"(ع) = م(ع) + م(ح2س).
تبخر الماء من المحلول :
> كتلة المذاب لا تتغير: ر"(ب) = ر(ب).
> تتناقص كتلة المحلول بمقدار كتلة الماء المتبخر: م"(ع) = م(ع) – م(ح2س).
دمج الحلين:مجموع كتل المحاليل وكتل المادة المذابة هو:
t"(B) = t(B) + t"(B);
ر"(ع) = ر(ع) + ر"(ع).
قطرة كريستال:يتم تقليل كتلة المذاب وكتلة المحلول بواسطة كتلة البلورات المترسبة:
م"(ب) = م(ب) - م(الرواسب)؛ م"(ع) = م(ع) - م(الرواسب).
كتلة الماء لا تتغير.
التأثير الحراري للتفاعل الكيميائي
* المحتوى الحراري لتكوين المادة ΔH°(B)، kJ/mol، هو المحتوى الحراري لتفاعل تكوين 1 مول من مادة من مواد بسيطة في حالاتها القياسية، أي عند ضغط ثابت (1 atm لكل غاز في النظام أو عند إجمالي ضغط 1 ATM في غياب المشاركين في التفاعل الغازي) ودرجة حرارة ثابتة (عادة 298 كلفن , أو 25 درجة مئوية).*التأثير الحراري للتفاعل الكيميائي (قانون هيس)
س = Σس(منتجات) - Σس(الكواشف).
ΔН° = ΣΔН°(المنتجات) – Σ ΔН°(الكواشف).
لرد الفعل أأ + ب ب +... = د + ه +...ΔH° = (dΔH°(D) + eΔH°(E) +…) - (aΔH°(A) + bΔH°(B) +…),
أين أ، ب، د، ه- الكميات المتكافئة للمواد المقابلة للمعاملات في معادلة التفاعل.معدل التفاعل الكيميائي
إذا كان خلال الوقت τ في الحجم الخامستغيرت كمية المادة المتفاعلة أو المنتج بمقدار Δ ن،سرعة التفاعل:
للتفاعل أحادي الجزيئي A →…:
الخامس = كج(أ).
للتفاعل الجزيئي A + B → ...:الخامس = كج(أ)ج(ب).
للتفاعل ثلاثي الجزيئات A + B + C → ...:الخامس = كج(أ) ج(ب) ج(ج).
تغيير معدل التفاعل الكيميائي
سرعة رد الفعل يزيد:1) كيميائيا نشيطالكواشف.
2) ترقيةتركيزات الكاشف
3) يزيد
4) ترقيةدرجة حرارة؛
5) المحفزات.سرعة رد الفعل يقلل:
1) كيميائيا غير نشطالكواشف.
2) خفض الرتبةتركيزات الكاشف
3) ينقصأسطح الكواشف الصلبة والسائلة.
4) خفض الرتبةدرجة حرارة؛
5) مثبطات.
*معامل سرعة درجة الحرارة(γ) يساوي رقمًا يوضح عدد المرات التي يزداد فيها معدل التفاعل عند زيادة درجة الحرارة بمقدار عشر درجات:
التوازن الكيميائي
* قانون عمل الكتلة للتوازن الكيميائي:في حالة التوازن، نسبة حاصل ضرب التركيزات المولية للمنتجات في القوى تساوي
معاملاتها المتكافئة، إلى ناتج التركيزات المولية للمواد المتفاعلة في قوى تساوي معاملاتها المتكافئة، عند درجة حرارة ثابتة هي قيمة ثابتة (ثابت توازن التركيز).
في حالة التوازن الكيميائي لتفاعل عكسي:
aA + bB + … ↔ dD + fF + …
ك ج = [د] د [و] و .../ [أ] أ [ب] ب ...
* تحول التوازن الكيميائي نحو تكوين النواتج
1) زيادة تركيز الكواشف.2) تقليل تركيز المنتجات.
3) زيادة في درجة الحرارة (لتفاعل ماص للحرارة)؛
4) انخفاض في درجة الحرارة (لتفاعل طارد للحرارة)؛
5) زيادة الضغط (لتفاعل يحدث مع انخفاض في الحجم)؛
6) انخفاض الضغط (لتفاعل يحدث مع زيادة في الحجم).
تبادل ردود الفعل في الحل
التفكك الكهربائي– عملية تكوين الأيونات (الكاتيونات والأنيونات) عند ذوبان بعض المواد في الماء.
الأحماضتتشكل كاتيونات الهيدروجينو الأنيونات الحمضية,على سبيل المثال:
HNO 3 = H + + NO 3 ¯
أثناء التفكك الكهربائي الأسبابتتشكل الكاتيونات المعدنيةوأيونات الهيدروكسيد، على سبيل المثال:هيدروكسيد الصوديوم = نا + + OH¯
أثناء التفكك الكهربائي أملاح(متوسطة، مزدوجة، مختلطة) تتشكل الكاتيونات المعدنيةوالأنيونات الحمضية، على سبيل المثال:نانو 3 = نا + + نو 3 ¯
كال (SO 4) 2 = K + + آل 3+ + 2SO 4 2-
أثناء التفكك الكهربائي أملاح حمضيةتتشكل الكاتيونات المعدنيةوالهيدرونيونات الحمضية، على سبيل المثال:NaHCO 3 = Na + + HCO 3 ‾
بعض الأحماض القوية
HBr، حمض الهيدروكلوريك، HClO 4، H 2 Cr 2 O 7، HI، HMnO 4، H 2 SO 4، H 2 SeO 4، HNO 3، H 2 CrO 4بعض الأسباب القوية
RbOH، CsOH، KOH، NaOH، LiOH، Ba(OH) 2، Sr(OH) 2، Ca(OH) 2درجة التفكك α- نسبة عدد الجزيئات المنفصلة إلى عدد الجزيئات الأولية.
عند حجم ثابت:
تصنيف المواد حسب درجة التفكك
حكم بيرثوليت
تستمر تفاعلات التبادل في المحلول بشكل لا رجعة فيه إذا كانت النتيجة تكوين راسب أو غاز أو إلكتروليت ضعيف.أمثلة على معادلات التفاعل الجزيئي والأيوني
1. المعادلة الجزيئية: CuCl 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaClالمعادلة الأيونية "الكاملة": Сu 2+ + 2Сl¯ + 2Na + + 2OH¯ = Cu(OH) 2 ↓ + 2Na + + 2Сl¯
المعادلة الأيونية "القصيرة": Cu 2+ + 2OH¯ = Cu(OH) 2 ↓
2. المعادلة الجزيئية: FeS (T) + 2HCl = FeCl 2 + H 2 S
المعادلة الأيونية "الكاملة": FeS + 2H + + 2Сl¯ = Fe 2+ + 2Сl¯ + H 2 S
المعادلة الأيونية "القصيرة": FeS (T) + 2H + = Fe 2+ + H 2 S
3. المعادلة الجزيئية: 3HNO 3 + K 3 PO 4 = H 3 PO 4 + 3KNO 3
المعادلة الأيونية "الكاملة": 3H + + 3NO 3 ¯ + 3K + + PO 4 3- = H 3 PO 4 + 3K + + 3NO 3 ¯
المعادلة الأيونية "القصيرة": 3H + + PO 4 3- = H 3 PO 4
*قيمة الهيدروجين
(الرقم الهيدروجيني) الرقم الهيدروجيني = – سجل = 14 + سجل* نطاق PH للمحاليل المائية المخففة
الرقم الهيدروجيني 7 (بيئة محايدة)أمثلة على ردود الفعل التبادلية
تفاعل التعادل- تفاعل تبادلي يحدث عندما يتفاعل حمض وقاعدة.1. قلوي + حمض قوي: Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Ba 2+ + 2OH¯ + 2H + + 2Сl¯ = Ba 2+ + 2Сl¯ + 2Н 2 O
ح + + OH¯ = ح 2 يا
2. قاعدة قابلة للذوبان قليلاً + حمض قوي: Cu(OH) 2(t) + 2HCl = CuCl 2 + 2H 2 O
Cu(OH) 2 + 2H + + 2Cl¯ = Cu 2+ + 2Cl¯ + 2H2O
النحاس(OH) 2 + 2H + = النحاس 2+ + 2H2O
*التحلل المائي– تفاعل تبادلي بين المادة والماء دون تغيير حالات أكسدة الذرات.
1. التحلل المائي الذي لا رجعة فيه للمركبات الثنائية:
ملغم 3 ن 2 + 6 ح 2 يا = 3 ملغم (أوه) 2 + 2 نه 3
2. التحلل المائي العكسي للأملاح:
أ) يتكون الملح كاتيون قاعدة قوية وأنيون حمض قوي:
كلوريد الصوديوم = Na + + Cl¯
نا + + ح 2 يا ≠ ;
Cl¯ + H2O ≠
لا يوجد التحلل المائي. بيئة محايدة، الرقم الهيدروجيني = 7.
ب) يتكون الملح كاتيون قاعدة قوية وأنيون حمض ضعيف:
نا 2 ق = 2نا + + ق 2-
نا + + ح 2 يا ≠
S 2- + H 2 O ↔ HS¯ + OH¯
التحلل المائي بواسطة الأنيون. البيئة القلوية، الرقم الهيدروجيني >7.
ب) يتكون الملح كاتيون قاعدة ضعيفة أو قليلة الذوبان وأنيون حمض قوي:
نهاية الجزء التمهيدي.
النص مقدم من لتر LLC.
يمكنك الدفع بأمان مقابل الكتاب باستخدام بطاقة Visa أو MasterCard أو Maestro المصرفية أو من حساب الهاتف المحمول أو من محطة الدفع أو في متجر MTS أو Svyaznoy أو عبر PayPal أو WebMoney أو Yandex.Money أو QIWI Wallet أو بطاقات المكافآت أو طريقة أخرى مناسبة لك.
تحقق من المعلومات. من الضروري التحقق من دقة الحقائق وموثوقية المعلومات المقدمة في هذه المقالة. وفي صفحة الحديث مناقشة حول موضوع: شبهات في الاصطلاح. الصيغة الكيميائية ويكيبيديا
تعكس الصيغة الكيميائية معلومات حول تركيب وبنية المواد باستخدام الرموز الكيميائية والأرقام ورموز القسمة بين الأقواس. حاليًا، يتم تمييز الأنواع التالية من الصيغ الكيميائية: الصيغة الأبسط. يمكن الحصول عليها من ذوي الخبرة... ... ويكيبيديا
تعكس الصيغة الكيميائية معلومات حول تركيب وبنية المواد باستخدام الرموز الكيميائية والأرقام ورموز القسمة بين الأقواس. حاليًا، يتم تمييز الأنواع التالية من الصيغ الكيميائية: الصيغة الأبسط. يمكن الحصول عليها من ذوي الخبرة... ... ويكيبيديا
تعكس الصيغة الكيميائية معلومات حول تركيب وبنية المواد باستخدام الرموز الكيميائية والأرقام ورموز القسمة بين الأقواس. حاليًا، يتم تمييز الأنواع التالية من الصيغ الكيميائية: الصيغة الأبسط. يمكن الحصول عليها من ذوي الخبرة... ... ويكيبيديا
تعكس الصيغة الكيميائية معلومات حول تركيب وبنية المواد باستخدام الرموز الكيميائية والأرقام ورموز القسمة بين الأقواس. حاليًا، يتم تمييز الأنواع التالية من الصيغ الكيميائية: الصيغة الأبسط. يمكن الحصول عليها من ذوي الخبرة... ... ويكيبيديا
المقال الرئيسي: المركبات غير العضوية قائمة المركبات غير العضوية حسب العنصر قائمة معلوماتية للمركبات غير العضوية مقدمة بالترتيب الأبجدي (حسب الصيغة) لكل مادة، وأحماض الهيدروجين للعناصر (إذا ... ... ويكيبيديا
هذه المقالة أو القسم يحتاج إلى مراجعة. يرجى تحسين المقالة بما يتوافق مع قواعد كتابة المقالات... ويكيبيديا
المعادلة الكيميائية (معادلة التفاعل الكيميائي) هي تمثيل تقليدي للتفاعل الكيميائي باستخدام الصيغ الكيميائية والمعاملات العددية والرموز الرياضية. معادلة التفاعل الكيميائي تعطي نوعية وكمية... ... ويكيبيديا
البرامج الكيميائية هي برامج حاسوبية تستخدم في مجال الكيمياء. المحتويات 1 المحررات الكيميائية 2 المنصات 3 الأدب ... ويكيبيديا
كتب
- قاموس ياباني-إنجليزي-روسي لتركيب المعدات الصناعية. حوالي 8000 مصطلح، Popova I.S. القاموس مخصص لمجموعة واسعة من المستخدمين وفي المقام الأول للمترجمين والمتخصصين الفنيين المشاركين في توريد وتنفيذ المعدات الصناعية من اليابان أو...
- قاموس مختصر للمصطلحات البيوكيميائية، Kunizhev S.M.. القاموس مخصص لطلاب التخصصات الكيميائية والبيولوجية في الجامعات الذين يدرسون دورة في الكيمياء الحيوية العامة وعلم البيئة وأساسيات التكنولوجيا الحيوية، ويمكن استخدامه أيضًا في ...
العديد من المفاهيم والصيغ الأساسية.
جميع المواد لها كتلة وكثافة وحجم مختلفة. يمكن لقطعة معدنية من عنصر واحد أن تزن عدة مرات أكثر من قطعة بنفس الحجم من معدن آخر.
خلد(عدد الشامات)
تعيين: خلد، دولي: مول- وحدة قياس كمية المادة. يتوافق مع كمية المادة التي تحتوي عليها لا.الجسيمات (الجزيئات، الذرات، الأيونات) لذلك تم إدخال كمية عالمية - عدد الشامات.العبارة التي يتم مواجهتها بشكل متكرر في المهام هي "تم استلام... مول المادة"
لا.= 6.02 1023
لا.- رقم أفوجادرو. وأيضا "الرقم بالاتفاق". كم عدد الذرات الموجودة في رأس قلم الرصاص؟ حوالي ألف. ليس من المناسب العمل بهذه الكميات. ولذلك، اتفق الكيميائيون والفيزيائيون في جميع أنحاء العالم - دعونا نحدد 6.02 × 1023 جسيمًا (ذرات، جزيئات، أيونات) على أنها 1 مول مواد.
1 مول = 6.021023 جسيم
كانت هذه أول الصيغ الأساسية لحل المشكلات.
الكتلة المولية للمادة
الكتلة الموليةالمادة هي كتلة واحد مول من المادة.
تمت الإشارة إليه مع السيد. تم العثور عليه وفقًا للجدول الدوري - فهو ببساطة مجموع الكتل الذرية للمادة.
على سبيل المثال، لدينا حمض الكبريتيك - H2SO4. دعونا نحسب الكتلة المولية للمادة: الكتلة الذرية H = 1، S-32، O-16.
Mr(H2SO4)=1 2+32+16 4=98 جم\مول.
الصيغة الثانية الضرورية لحل المشاكل هي
صيغة كتلة المادة:
أي أنه للعثور على كتلة المادة، عليك معرفة عدد الشامات (ن)، ونجد الكتلة المولية من الجدول الدوري.
قانون حفظ الكتلة -إن كتلة المواد التي تدخل في التفاعل الكيميائي تساوي دائمًا كتلة المواد الناتجة.
إذا عرفنا كتلة (كتل) المواد المتفاعلة، فيمكننا العثور على كتلة (كتل) منتجات هذا التفاعل. والعكس صحيح.
الصيغة الثالثة لحل مسائل الكيمياء هي
حجم المادة:
عذرًا، هذه الصورة لا تتوافق مع إرشاداتنا. لمواصلة النشر، يرجى حذف الصورة أو تحميل صورة أخرى.من أين أتى الرقم 22.4؟ من قانون أفوجادرو:
تحتوي الحجوم المتساوية من الغازات المختلفة المأخوذة عند نفس درجة الحرارة والضغط على نفس العدد من الجزيئات.
وفقًا لقانون أفوجادرو، فإن 1 مول من الغاز المثالي في الظروف العادية (ns) له نفس الحجم جهاز افتراضي= 22.413 996(39) لتر
وهذا يعني أنه إذا تم إعطاؤنا ظروفًا طبيعية في المشكلة، فمن خلال معرفة عدد الشامات (ن)، يمكننا العثور على حجم المادة.
لذا، الصيغ الأساسية لحل المشاكلفي الكيمياء
رقم أفوجادرولا.
6.02 1023 جسيم
كمية المادةن (مول)
ن=V\22.4 (لتر\مول)
كتلة المادةم (ز)
حجم المادة V(ل)
V=n 22.4 (لتر\مول)
عذرًا، هذه الصورة لا تتوافق مع إرشاداتنا. لمواصلة النشر، يرجى حذف الصورة أو تحميل صورة أخرى.هذه هي الصيغ. في كثير من الأحيان، لحل المشكلات، تحتاج أولاً إلى كتابة معادلة التفاعل و(مطلوب!) ترتيب المعاملات - حيث تحدد نسبتها نسبة الشامات في العملية.
الكلمات المفتاحية: الكيمياء الصف الثامن. جميع الصيغ والتعاريف، رموز الكميات الفيزيائية، وحدات القياس، بادئات تسمية وحدات القياس، العلاقات بين الوحدات، الصيغ الكيميائية، التعاريف الأساسية، باختصار، الجداول، الرسوم البيانية.
1. الرموز والأسماء ووحدات القياس
بعض الكميات الفيزيائية المستخدمة في الكيمياء
| الكمية المادية | تعيين | وحدة |
| وقت | ر | مع |
| ضغط | ص | باسكال، كيلو باسكال |
| كمية المادة | ν | خلد |
| كتلة المادة | م | كجم، ز |
| جزء الشامل | ω | بلا أبعاد |
| الكتلة المولية | م | كجم / مول، جم / مول |
| الحجم المولي | Vn | م 3 / مول، لتر / مول |
| حجم المادة | الخامس | م 3، ل |
| جزء الحجم | بلا أبعاد | |
| الكتلة الذرية النسبية | أ ص | بلا أبعاد |
| السيد | بلا أبعاد | |
| الكثافة النسبية للغاز أ إلى الغاز ب | دب (أ) | بلا أبعاد |
| كثافة المادة | ر | كجم/م3، جم/سم3، جم/مل |
| ثابت أفوجادرو | ن أ | 1/مول |
| درجة الحرارة المطلقة | ت | ك (كلفن) |
| درجة الحرارة في مئوية | ر | درجة مئوية (درجة مئوية) |
| التأثير الحراري للتفاعل الكيميائي | س | كيلوجول / مول |

2. العلاقات بين وحدات الكميات الفيزيائية

3. الصيغ الكيميائية في الصف الثامن
4. التعاريف الأساسية في الصف الثامن

- ذرة- أصغر جسيم غير قابل للتجزئة كيميائيا من المادة.
- عنصر كيميائي- نوع معين من الذرة .
- مركب- أصغر جسيم من المادة يحتفظ بتركيبته وخواصه الكيميائية ويتكون من ذرات.
- مواد بسيطة- المواد التي تتكون جزيئاتها من ذرات من نفس النوع.
- المواد المعقدة- المواد التي تتكون جزيئاتها من ذرات مختلفة الأنواع.
- التركيب النوعي للمادة يوضح ذرات العناصر التي يتكون منها.
- التركيب الكمي للمادة يبين عدد ذرات كل عنصر في تركيبته.
- صيغة كيميائية- التسجيل التقليدي للتركيب النوعي والكمي للمادة باستخدام الرموز والمؤشرات الكيميائية.
- وحدة كتلة ذرية(amu) - وحدة قياس الكتلة الذرية تساوي كتلة 1/12 من ذرة الكربون 12 درجة مئوية.
- خلد- كمية المادة التي تحتوي على عدد من الجزيئات تساوي عدد الذرات في 0.012 كجم من الكربون 12C.
- ثابت أفوجادرو (نا = 6*10 23 مول -1) - عدد الجزيئات الموجودة في المول الواحد.
- الكتلة المولية للمادة (م ) هي كتلة المادة المأخوذة بمقدار 1 مول.
- الكتلة الذرية النسبيةعنصر أ ص - نسبة كتلة ذرة عنصر معين م 0 إلى 1/12 من كتلة ذرة الكربون 12 درجة مئوية.
- الوزن الجزيئي النسبيمواد م ص - نسبة كتلة جزيء مادة معينة إلى 1/12 من كتلة ذرة الكربون 12 درجة مئوية. الكتلة الجزيئية النسبية تساوي مجموع الكتل الذرية النسبية للعناصر الكيميائية المكونة للمركب، مع الأخذ مع الأخذ في الاعتبار عدد ذرات عنصر معين.
- جزء الشاملعنصر كيميائي ω(X)يوضح أي جزء من الكتلة الجزيئية النسبية للمادة X يمثله عنصر معين.
التدريس الذري الجزيئي
1. هناك مواد ذات بنية جزيئية وغير جزيئية.
2. توجد فجوات بين الجزيئات يعتمد حجمها على حالة تجمع المادة ودرجة الحرارة.
3. الجزيئات في حركة مستمرة.
4. تتكون الجزيئات من ذرات.
6. تتميز الذرات بكتلة وحجم معينين.
أثناء الظواهر الفيزيائية، يتم الحفاظ على الجزيئات أثناء الظواهر الكيميائية، كقاعدة عامة، يتم تدميرها. يتم إعادة ترتيب الذرات أثناء الظواهر الكيميائية، لتشكل جزيئات من مواد جديدة.

قانون التركيب الثابت للمادة
كل مادة نقية كيميائيا ذات بنية جزيئية، بغض النظر عن طريقة تحضيرها، لها تركيبة نوعية وكمية ثابتة.
التكافؤ
التكافؤ هو خاصية ذرة عنصر كيميائي لربط أو استبدال عدد معين من ذرات عنصر آخر.

تفاعل كيميائي
التفاعل الكيميائي هو ظاهرة تنتج عنها مواد أخرى من مادة واحدة. المواد المتفاعلة هي المواد التي تدخل في التفاعل الكيميائي. منتجات التفاعل هي مواد تتشكل نتيجة للتفاعل.
علامات التفاعلات الكيميائية:
1. إطلاق الحرارة (الضوء).
2. تغير اللون.
3. ظهور الرائحة.
4. تكوين الرواسب.
5. إطلاق الغاز.




 الخامس م= 22.4 لتر/مول (ns)
الخامس م= 22.4 لتر/مول (ns)