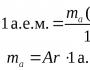Samling af formler i kemi. Grundlæggende formler til løsning af problemer
|
Størrelse og dens dimension |
Forhold |
|
Atommasse af grundstof X (relativ) |
|
|
Elementets serienummer |
Z= N(e –) = N(R +) |
|
Massefraktion af grundstof E i stof X, i fraktioner af en enhed, i %) |
|
|
Mængde af stof X, mol | |
|
Mængde af gasstof, mol |
Godt. – R= 101 325 Pa, T= 273 K |
|
Molær masse af stof X, g/mol, kg/mol |
|
|
Masse af stof X, g, kg |
m(X) = n(X) M(X) |
|
Molært volumen gas, l/mol, m 3 /mol |
V m= 22,4 l/mol ved N.S. |
|
Gasvolumen, m 3 |
V = V m × n |
|
Produktudbytte |
|
|
Densitet af stof X, g/l, g/ml, kg/m 3 |
|
|
Densitet af gasformigt stof X ved brint |
|
|
Massefylde af gasformigt stof X i luft |
M(luft) = 29 g/mol |
|
United Gas Law |
|
|
Mendeleev-Clapeyron ligning |
PV = nRT, R= 8,314 J/mol × K |
|
Volumenfraktion af et gasformigt stof i en blanding af gasser, i fraktioner af en enhed eller i % |
|
|
Molær masse af en blanding af gasser |
|
|
Molfraktion af et stof (X) i en blanding |
|
|
Varmemængde, J, kJ |
Q = n(X) Q(X) |
|
Termisk effekt af reaktion |
Q =–H |
|
Dannelsesvarme af stof X, J/mol, kJ/mol |
|
|
Kemisk reaktionshastighed (mol/lsek.) |
|
|
Lov om massehandling (for en simpel reaktion) |
-en A+ V B= Med C+ d D u = k Med -en(A) Med V(B) |
|
Van't Hoffs regel |
|
|
Opløselighed af stoffet (X) (g/100 g opløsningsmiddel) |
|
|
Massefraktion af stof X i blanding A + X, i fraktioner af en enhed, i % |
|
|
Opløsningens vægt, g, kg |
m(rr) = m(X)+ m(H2O) m(rr) = V(rr) (rr) |
|
Massefraktion af opløst stof i opløsning, i fraktioner af en enhed, i % |
|
|
Opløsningstæthed |
|
|
Opløsningsvolumen, cm 3, l, m 3 |
|
|
Molær koncentration, mol/l |
|
|
Grad af elektrolytdissociation (X), i brøkdele af en enhed eller % |
|
|
Ionisk produkt af vand |
K(H2O) = |
|
pH-værdi |
pH = -lg |
Hoved:
Kuznetsova N.E. og osv. Kemi. 8. klasse-10. klasse – M.: Ventana-Graf, 2005-2007.
Kuznetsova N.E., Litvinova T.N., Levkin A.N. Kemi.11. klasse i 2 dele, 2005-2007.
Egorov A.S. Kemi. En ny lærebog til forberedelse til videregående uddannelse. Rostov n/d: Phoenix, 2004.– 640 s.
Egorov A.S. Kemi: et moderne kursus til forberedelse til Unified State Exam. Rostov n/a: Phoenix, 2011. (2012) – 699 s.
Egorov A.S. Selvbetjeningsvejledning til løsning af kemikalieproblemer. – Rostov ved Don: Phoenix, 2000. – 352 s.
Kemi/vejledermanual for ansøgere til universiteter. Rostov-n/D, Phoenix, 2005– 536 s.
Khomchenko G.P., Khomchenko I.G.. Problemer i kemi for ansøgere til universiteter. M.: Højere skole. 2007.–302s.
Ekstra:
Vrublevsky A.I.. Uddannelses- og træningsmaterialer til forberedelse til centraliseret test i kemi / A.I. Vrublevsky –Mn.: Unipress LLC, 2004. – 368 s.
Vrublevsky A.I.. 1000 problemer i kemi med kæder af transformationer og kontroltests for skolebørn og ansøgere – Mn.: Unipress LLC, 2003. – 400 s.
Egorov A.S.. Alle typer regneproblemer i kemi til forberedelse til Unified State-eksamen – Rostov n/D: Phoenix, 2003. – 320 s.
Egorov A.S., Aminova G.Kh.. Typiske opgaver og øvelser til forberedelse til kemieksamen. – Rostov n/d: Phoenix, 2005. – 448 s.
Unified State Exam 2007. Kemi. Uddannelses- og træningsmaterialer til forberedelse af elever / FIPI - M.: Intellect-Center, 2007. – 272 s.
Unified State eksamen 2011. Kemi. Uddannelses- og træningssæt udg. A.A. Kaverina. – M.: National Education, 2011.
De eneste rigtige muligheder for opgaver at forberede sig til Unified State Exam. Unified State Examination 2007. Kemi/V.Yu. Mishina, E.N. Strelnikova. M.: Federal Testing Center, 2007.–151 s.
Kaverina A.A. Den optimale bank af opgaver til at forberede eleverne. Unified State Exam 2012. Kemi. Lærebog./ A.A. Kaverina, D.Yu. Dobrotin, Yu.N. Medvedev, M.G. Snastina. – M.: Intellekt-Center, 2012. – 256 s.
Litvinova T.N., Vyskubova N.K., Azhipa L.T., Solovyova M.V.. Testopgaver udover test for studerende af 10-måneders korrespondanceforberedende kurser (metodevejledning). Krasnodar, 2004. – S. 18 – 70.
Litvinova T.N.. Kemi. Unified State eksamen 2011. Træningsprøver. Rostov n/d: Phoenix, 2011.– 349 s.
Litvinova T.N.. Kemi. Test til Unified State-eksamenen. Rostov n/d.: Phoenix, 2012. - 284 s.
Litvinova T.N.. Kemi. Love, egenskaber ved grundstoffer og deres forbindelser. Rostov n/d.: Phoenix, 2012. - 156 s.
Litvinova T.N., Melnikova E.D., Solovyova M.V.., Azhipa L.T., Vyskubova N.K. Kemi i opgaver for ansøgere til universiteter – M.: Onyx Publishing House LLC: Mir and Education Publishing House LLC, 2009. – 832 s.
Uddannelses- og metodologisk kompleks i kemi for studerende i medicinske og biologiske klasser, red. T.N. Litvinova – Krasnodar.: KSMU, – 2008.
Kemi. Unified State eksamen 2008. Adgangsprøver, læremiddel / red. V.N. Doronkina. – Rostov n/d: Legion, 2008.– 271 s.
Liste over websteder om kemi:
1. Alhimik. http:// www. alhimik. ru
2. Kemi for alle. Elektronisk opslagsbog til et komplet kemikursus.
http:// www. informika. ru/ tekst/ database/ kemi/ START. html
3. Skolekemi - opslagsbog. http:// www. skolekemi. ved. ru
4. Kemivejleder. http://www. chemistry.nm.ru
Internetressourcer
Alhimik. http:// www. alhimik. ru
Kemi for alle. Elektronisk opslagsbog til et komplet kemikursus.
http:// www. informika. ru/ tekst/ database/ kemi/ START. html
Skolekemi - opslagsbog. http:// www. skolekemi. ved. ru
http://www.classchem.narod.ru
Kemi underviser. http://www. chemistry.nm.ru
http://www.alleng.ru/edu/chem.htm- pædagogiske internetressourcer om kemi
http://schoolchemistry.by.ru/- skolekemi. Dette websted har mulighed for at tage online test om forskellige emner, såvel som demoversioner af Unified State Exam
Kemi og liv - XXI århundrede: populærvidenskabeligt magasin. http:// www. hij. ru
Indsamling af grundlæggende formler for et skolekemikursus
Indsamling af grundlæggende formler for et skolekemikursus
G.P. Loginova
Elena Savinkina
E. V. Savinkina G. P. Loginova
Samling af grundlæggende formler i kemi
Elevens lommevejledning
generel kemi
De vigtigste kemiske begreber og love
Kemisk grundstof- dette er en bestemt type atom med samme nukleare ladning.
Relativ atommasse(A r) viser, hvor mange gange massen af et atom i et givet grundstof er større end massen af et kulstof-12 atom (12 C).
Kemisk stof– en samling af eventuelle kemiske partikler.
Kemiske partikler
Formel enhed– en konventionel partikel, hvis sammensætning svarer til den givne kemiske formel, f.eks.Ar – argonstof (består af Ar-atomer),
H 2 O - stoffet vand (består af H 2 O-molekyler),
KNO 3 – kaliumnitratstof (består af K + kationer og NO 3 ¯ anioner).
Sammenhæng mellem fysiske størrelser
Atommasse (relativ) af grundstoffet B, A r (B):Hvor *T(atom B) - massen af et atom af element B;
*t og– atommasseenhed;
*t og = 1/12 T(12 C-atom) = 1,6610 24 g.
Mængde af stof B, n(B), mol:
Hvor N(B)– antal partikler B;
N A– Avogadros konstant (NA = 6,0210 23 mol-1).
Molær masse af et stof V, M(V), g/mol:
Hvor t(V)- masse B.
Molært volumen af gas I, V M l/mol:
Hvor VM = 22,4 l/mol (konsekvens fra Avogadros lov), under normale forhold (n.s. - atmosfærisk tryk p = 101.325 Pa (1 atm); termodynamisk temperatur T = 273,15 K eller Celsius temperatur t = 0°C).
B for brint, D(gas B ved H 2):
*Tæthed af gasformigt stof I med fly, D(gas B over luft): Massefraktion af grundstof E i materien V, w(E):Hvor x er antallet af E-atomer i formlen for stof B
Atomets struktur og den periodiske lov D.I. Mendeleev
Massetal (A) – det samlede antal protoner og neutroner i atomkernen:
A = N(po) + N(p+).
Atomisk nuklear ladning (Z) lig med antallet af protoner i kernen og antallet af elektroner i atomet:Z = N(p+) = N(e¯).
Isotoper– atomer af samme grundstof, der er forskellige i antallet af neutroner i kernen, for eksempel: kalium-39: 39 K (19 p + , 20n 0, 19e¯); kalium-40: 40 K (19 p+, 21n 0, 19e¯).*Energiniveauer og underniveauer
*Atomorbital(AO) karakteriserer det område af rummet, hvor sandsynligheden for, at en elektron med en bestemt energi befinder sig, er størst.*Former af s- og p-orbitaler
Periodisk lov og periodisk system D.I. Mendeleev
Grundstoffernes og deres forbindelsers egenskaber gentages periodisk med stigende atomnummer, som er lig med ladningen af kernen af grundstoffets atom.Periodenummer svarer antal energiniveauer fyldt med elektroner, og står for det sidste energiniveau, der skal udfyldes(EU).
Gruppe nummer A viser sig Og etc.
Gruppe nummer B viser sig antal valenselektroner ns Og (n – 1)d.
S-elementer sektion– energiunderniveauet (ESL) er fyldt med elektroner ns-EPU– IA- og IIA-grupper, H og He.
p-elementer afsnit– fyldt med elektroner np-EPU– IIIA-VIIIA-grupper.
D-elementer sektion– fyldt med elektroner (P- 1) d-EPU – IB-VIIIB2-grupper.
f-elementer sektion– fyldt med elektroner (S-2) f-EPU – lanthanider og actinider.
Ændringer i sammensætningen og egenskaberne af brintforbindelser af elementer fra den 3. periode af det periodiske system
Ikke-flygtig, nedbrydes med vand: NaH, MgH 2, AlH 3.Flygtig: SiH 4, PH 3, H 2 S, HCl.
Ændringer i sammensætningen og egenskaberne af højere oxider og hydroxider af grundstoffer fra den 3. periode af det periodiske system
Grundlæggende: Na 2 O – NaOH, MgO – Mg(OH) 2.Amfoterisk: Al 2 O 3 – Al(OH) 3.
Syrlig: SiO 2 – H 4 SiO 4, P 2 O 5 – H 3 PO 4, SO 3 – H 2 SO 4, Cl 2 O 7 – HClO 4.
Kemisk binding
Elektronegativitet(χ) er en størrelse, der karakteriserer et atoms evne i et molekyle til at erhverve en negativ ladning.Mekanismer for dannelse af kovalente bindinger
Udvekslingsmekanisme- overlapningen af to orbitaler af naboatomer, som hver havde en elektron.Donor-acceptor mekanisme– overlapning af en fri orbital af et atom med en orbital af et andet atom, der indeholder et par elektroner.
Overlapning af orbitaler under bindingsdannelse
*Type hybridisering – geometrisk form af partiklen – vinkel mellem bindinger
Hybridisering af centrale atomorbitaler– tilpasning af deres energi og form.sp– lineær – 180°
sp 2– trekantet – 120°
sp 3– tetraedrisk – 109,5°
sp 3 d– trigonal-bipyramidal – 90°; 120°
sp 3 d 2– oktaedral – 90°
Blandinger og opløsninger
Løsning- et homogent system bestående af to eller flere stoffer, hvis indhold kan varieres inden for visse grænser.
Løsning: opløsningsmiddel (f.eks. vand) + opløst stof.
Ægte løsninger indeholder partikler mindre end 1 nanometer.
Kolloide opløsninger indeholder partikler i størrelse fra 1 til 100 nanometer.
Mekaniske blandinger(suspensioner) indeholder partikler større end 100 nanometer.
Affjedring=> fast + væske
Emulsion=> væske + væske
Skum, tåge=> gas + væske
Heterogene blandinger adskilles bundfældning og filtrering.
Homogene blandinger adskilles inddampning, destillation, kromatografi.
Mættet opløsning er eller kan være i ligevægt med det opløste stof (hvis det opløste stof er fast, så er dets overskud i bundfaldet).
Opløselighed– indholdet af det opløste stof i en mættet opløsning ved en given temperatur.
Umættet opløsning mindre,
Overmættet løsning indeholder opløst stof mere, end dets opløselighed ved en given temperatur.
Sammenhæng mellem fysisk-kemiske mængder i opløsning
Massefraktion af opløst stof I, w(B); brøkdel af en enhed eller %:Hvor t(V)– masse B,
t(r)- masse af opløsning.
Opløsningens vægt, m(p), g:
m(p) = m(B) + m(H2O) = V(p) ρ(p),
hvor F(p) er opløsningens rumfang;ρ(p) – opløsningsdensitet.
Opløsningsvolumen, V(p), l:
Molær koncentration, s(V), mol/l:Hvor n(B) er mængden af stof B;
M(B) - molær masse af stof B.
Ændring af opløsningens sammensætning
Fortynding af opløsningen med vand:> t"(V)= t(B);
> massen af opløsningen stiger med massen af tilsat vand: m"(p) = m(p) + m(H20).
Fordampning af vand fra en opløsning:
> massen af det opløste stof ændres ikke: t"(B) = t(B).
> massen af opløsningen falder med massen af fordampet vand: m"(p) = m(p) – m(H20).
Sammenlægning af to løsninger: Masserne af opløsninger, såvel som masserne af det opløste stof, summeres:
t"(B) = t(B) + t"(B);
t"(p) = t(p) + t"(p).
Krystaldråbe: massen af det opløste stof og massen af opløsningen reduceres med massen af udfældede krystaller:
m"(B) = m(B) – m(sediment); m"(p) = m(p) – m(sediment).
Vandmassen ændres ikke.
Termisk effekt af en kemisk reaktion
*Entalpi ved dannelse af et stof ΔH°(B), kJ/mol, er entalpien for reaktionen ved dannelse af 1 mol af et stof fra simple stoffer i deres standardtilstande, det vil sige ved konstant tryk (1 atm for hver gas i systemet eller ved i alt tryk på 1 atm i fravær af gasformige reaktionsdeltagere) og konstant temperatur (normalt 298 K , eller 25 °C).* Termisk effekt af en kemisk reaktion (Hess lov)
Q = ΣQ(Produkter) - ΣQ(reagenser).
ΔН° = ΣΔН°(produkter) – Σ ΔН°(reagenser).
Til reaktion aA + bB +… = dD + eE +…ΔH° = (dΔH°(D) + eΔH°(E) +...) – (aΔH°(A) + bΔH°(B) +...),
Hvor a, b, d, e– støkiometriske mængder af stoffer svarende til koefficienterne i reaktionsligningen.Kemisk reaktionshastighed
Hvis i løbet af tiden τ i volumen V mængden af reaktant eller produkt ændret med Δ n, hastighedsreaktion:
For en monomolekylær reaktion A → …:
v = k c(A).
For den bimolekylære reaktion A + B → ...:v = k c(A) c(B).
For den trimolekylære reaktion A + B + C → ...:v = k c(A) c(B) c(C).
Ændring af hastigheden af en kemisk reaktion
Hastighedsreaktion øge:1) kemisk aktiv reagenser;
2) forfremmelse reagenskoncentrationer;
3) øge
4) forfremmelse temperatur;
5) katalysatorer. Hastighedsreaktion reducere:
1) kemisk inaktiv reagenser;
2) degradering reagenskoncentrationer;
3) formindske overflader af faste og flydende reagenser;
4) degradering temperatur;
5) inhibitorer.
* Temperaturhastighedskoefficient(γ) er lig med et tal, der viser, hvor mange gange reaktionshastigheden stiger, når temperaturen stiger med ti grader:
Kemisk ligevægt
*Lov om massevirkning for kemisk ligevægt: i en ligevægtstilstand, forholdet mellem produktet af de molære koncentrationer af produkter i potenser lig med
Deres støkiometriske koefficienter, til produktet af de molære koncentrationer af reaktanterne i potenser lig med deres støkiometriske koefficienter, ved en konstant temperatur er en konstant værdi (koncentrationsligevægtskonstant).
I en tilstand af kemisk ligevægt for en reversibel reaktion:
aA + bB + … ↔ dD + fF + …
K c = [D] d [F] f .../ [A] a [B] b ...
*Skift i kemisk ligevægt mod dannelse af produkter
1) Forøgelse af koncentrationen af reagenser;2) reduktion af koncentrationen af produkter;
3) stigning i temperatur (for en endoterm reaktion);
4) fald i temperatur (for en eksoterm reaktion);
5) stigning i tryk (for en reaktion, der forekommer med et fald i volumen);
6) fald i tryk (for en reaktion, der forekommer med en stigning i volumen).
Udveksle reaktioner i opløsning
Elektrolytisk dissociation– processen med dannelse af ioner (kationer og anioner), når visse stoffer opløses i vand.
syrer er dannet brintkationer Og sure anioner, For eksempel:
HNO3 = H+ + NO3¯
Under elektrolytisk dissociation grunde er dannet metalkationer og hydroxidioner, for eksempel:NaOH = Na + + OH¯
Under elektrolytisk dissociation salte(medium, dobbelt, blandet) dannes metalkationer og sure anioner, for eksempel:NaNO3 = Na + + NO3 ¯
KAl(SO 4) 2 = K + + Al 3+ + 2SO 4 2-
Under elektrolytisk dissociation sure salte er dannet metalkationer og sure hydroanioner, for eksempel:NaHCO 3 = Na + + HCO 3 ‾
Nogle stærke syrer
HBr, HCl, HClO 4, H 2 Cr 2 O 7, HI, HMnO 4, H 2 SO 4, H 2 SeO 4, HNO 3, H 2 CrO 4Nogle stærke grunde
RbOH, CsOH, KOH, NaOH, LiOH, Ba(OH)2, Sr(OH)2, Ca(OH)2Dissociationsgrad α– forholdet mellem antallet af dissocierede partikler og antallet af initiale partikler.
Ved konstant volumen:
Klassificering af stoffer efter grad af dissociation
Berthollets regel
Udvekslingsreaktioner i opløsning forløber irreversibelt, hvis resultatet er dannelsen af et bundfald, gas eller svag elektrolyt.Eksempler på molekylære og ioniske reaktionsligninger
1. Molekylligning: CuCl 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaCl"Fuldstændig" ionisk ligning: Сu 2+ + 2Сl¯ + 2Na + + 2OH¯ = Cu(OH) 2 ↓ + 2Na + + 2Сl¯
"Kort" ionisk ligning: Cu 2+ + 2OH¯ = Cu(OH) 2 ↓
2. Molekylær ligning: FeS (T) + 2HCl = FeCl 2 + H 2 S
"Fuldstændig" ionisk ligning: FeS + 2H + + 2Сl¯ = Fe 2+ + 2Сl¯ + H 2S
"Kort" ionisk ligning: FeS (T) + 2H + = Fe 2+ + H 2 S
3. Molekylær ligning: 3HNO 3 + K 3 PO 4 = H 3 PO 4 + 3KNO 3
"Fuldstændig" ionisk ligning: 3H + + 3NO 3 ¯ + 3K + + PO 4 3- = H 3 PO 4 + 3K + + 3NO 3 ¯
"Kort" ionisk ligning: 3H + + PO 4 3- = H 3 PO 4
*Brintværdi
(pH) pH = – log = 14 + log*pH-område for fortyndede vandige opløsninger
pH 7 (neutralt miljø)Eksempler på udvekslingsreaktioner
Neutraliseringsreaktion- en udvekslingsreaktion, der opstår, når en syre og en base interagerer.1. Alkali + stærk syre: Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Ba 2+ + 2ON¯ + 2H + + 2Сl¯ = Ba 2+ + 2Сl¯ + 2Н 2 O
H+ + OH¯ = H2O
2. Lidt opløselig base + stærk syre: Cu(OH) 2(t) + 2HCl = CuCl 2 + 2H 2 O
Cu(OH)2 + 2H + + 2Cl¯ = Cu 2+ + 2Cl¯ + 2H 2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
*Hydrolyse– en udvekslingsreaktion mellem et stof og vand uden at ændre atomernes oxidationstilstande.
1. Irreversibel hydrolyse af binære forbindelser:
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
2. Reversibel hydrolyse af salte:
A) Der dannes salt en stærk basekation og en stærk syreanion:
NaCl = Na + + Сl¯
Na + + H2O ≠ ;
Cl¯ + H2O ≠
Der er ingen hydrolyse; neutralt miljø, pH = 7.
B) Der dannes salt en stærk basekation og en svag syreanion:
Na 2S = 2Na + + S 2-
Na + + H2O ≠
S 2- + H 2 O ↔ HS¯ + OH¯
Hydrolyse ved anion; alkalisk miljø, pH >7.
B) Der dannes salt en kation af en svag eller svagt opløselig base og en anion af en stærk syre:
Slut på indledende fragment.
Tekst leveret af liters LLC.
Du kan trygt betale for bogen med et Visa, MasterCard, Maestro bankkort, fra en mobiltelefonkonto, fra en betalingsterminal, i en MTS eller Svyaznoy butik, via PayPal, WebMoney, Yandex.Money, QIWI Wallet, bonuskort eller en anden metode, der er praktisk for dig.
Tjek oplysninger. Det er nødvendigt at kontrollere nøjagtigheden af fakta og pålideligheden af de oplysninger, der præsenteres i denne artikel. På diskussionssiden er der en diskussion om emnet: Tvivl vedrørende terminologi. Kemisk formel ... Wikipedia
En kemisk formel afspejler information om stoffers sammensætning og struktur ved hjælp af kemiske symboler, tal og delesymboler i parentes. I øjeblikket skelnes der mellem følgende typer af kemiske formler: Den enkleste formel. Kan fås af erfarne... ... Wikipedia
En kemisk formel afspejler information om stoffers sammensætning og struktur ved hjælp af kemiske symboler, tal og delesymboler i parentes. I øjeblikket skelnes der mellem følgende typer af kemiske formler: Den enkleste formel. Kan fås af erfarne... ... Wikipedia
En kemisk formel afspejler information om stoffers sammensætning og struktur ved hjælp af kemiske symboler, tal og delesymboler i parentes. I øjeblikket skelnes der mellem følgende typer af kemiske formler: Den enkleste formel. Kan fås af erfarne... ... Wikipedia
En kemisk formel afspejler information om stoffers sammensætning og struktur ved hjælp af kemiske symboler, tal og delesymboler i parentes. I øjeblikket skelnes der mellem følgende typer af kemiske formler: Den enkleste formel. Kan fås af erfarne... ... Wikipedia
Hovedartikel: Uorganiske forbindelser Liste over uorganiske forbindelser efter grundstof informationsliste over uorganiske forbindelser præsenteret i alfabetisk rækkefølge (efter formel) for hvert stof, grundstoffernes brintsyrer (hvis ... ... Wikipedia
Denne artikel eller sektion trænger til revision. Venligst forbedre artiklen i overensstemmelse med reglerne for at skrive artikler... Wikipedia
En kemisk ligning (ligning for en kemisk reaktion) er en konventionel fremstilling af en kemisk reaktion ved hjælp af kemiske formler, numeriske koefficienter og matematiske symboler. Ligningen for en kemisk reaktion giver kvalitativ og kvantitativ... ... Wikipedia
Kemisk software er computerprogrammer, der bruges inden for kemi. Indhold 1 Kemiske redaktører 2 Platforme 3 Litteratur ... Wikipedia
Bøger
- Japansk-engelsk-russisk ordbog til installation af industrielt udstyr. Omkring 8.000 termer, Popova I.S.. Ordbogen er beregnet til en bred vifte af brugere og primært til oversættere og tekniske specialister involveret i levering og implementering af industrielt udstyr fra Japan eller...
- En kort ordbog over biokemiske termer, Kunizhev S.M.. Ordbogen er beregnet til studerende af kemiske og biologiske specialer på universiteter, der studerer et kursus i generel biokemi, økologi og bioteknologiens grundlæggende principper, og kan også bruges i ...
flere grundlæggende begreber og formler.
Alle stoffer har forskellig masse, tæthed og volumen. Et stykke metal fra et element kan veje mange gange mere end et nøjagtigt samme størrelse stykke af et andet metal.
Muldvarp(antal mol)
betegnelse: muldvarp, international: mol- en måleenhed for mængden af et stof. Svarer til mængden af stof, der indeholder N.A. partikler (molekyler, atomer, ioner) Derfor blev der indført en universel mængde - antal mol. En ofte stødt på sætning i opgaver er "modtaget... mol stof"
N.A.= 6,02 1023
N.A.- Avogadros nummer. Også "et nummer efter aftale." Hvor mange atomer er der i spidsen af en blyant? Omkring tusind. Det er ikke praktisk at arbejde med sådanne mængder. Derfor var kemikere og fysikere over hele verden enige om - lad os udpege 6,02 × 1023 partikler (atomer, molekyler, ioner) som 1 muldvarp stoffer.
1 mol = 6,02 1023 partikler
Dette var den første af de grundlæggende formler til løsning af problemer.
Molær masse af et stof
Molar masse stof er massen af en mol stof.
Benævnt Hr. Det findes ifølge det periodiske system - det er simpelthen summen af et stofs atommasse.
For eksempel får vi svovlsyre - H2SO4. Lad os beregne molmassen af et stof: atommasse H = 1, S-32, O-16.
Mr(H2SO4)=12+32+16 4=98 g\mol.
Den anden nødvendige formel til at løse problemer er
stofmasseformel:
Det vil sige, at for at finde massen af et stof skal man kende antallet af mol (n), og vi finder molmassen ud fra det periodiske system.
Lov om bevarelse af masse - Massen af stoffer, der indgår i en kemisk reaktion, er altid lig med massen af de resulterende stoffer.
Hvis vi kender massen/masserne af de stoffer, der reagerede, kan vi finde massen/masserne af produkterne fra den reaktion. Og omvendt.
Den tredje formel til løsning af problemer i kemi er
volumen af stof:
Beklager, dette billede overholder ikke vores retningslinjer. For at fortsætte udgivelsen skal du slette billedet eller uploade et andet.Hvor kom tallet 22,4 fra? Fra Avogadros lov:
lige store mængder af forskellige gasser taget ved samme temperatur og tryk indeholder det samme antal molekyler.
Ifølge Avogadros lov har 1 mol af en ideel gas under normale forhold (n.s.) samme volumen Vm= 22.413 996(39) l
Det vil sige, at hvis vi i problemet får normale forhold, så kan vi, ved at kende antallet af mol (n), finde stoffets volumen.
Så, grundlæggende formler til løsning af problemer i kemi
Avogadros nummerN.A.
6,02 1023 partikler
Mængde af stof n (mol)
n=V\22,4 (l\mol)
Masse af stof m (g)
Volumen af stof V(l)
V=n 22,4 (l\mol)
Beklager, dette billede overholder ikke vores retningslinjer. For at fortsætte udgivelsen skal du slette billedet eller uploade et andet.Det er formler. For at løse problemer skal du ofte først skrive reaktionsligningen og (påkrævet!) arrangere koefficienterne - deres forhold bestemmer forholdet mellem mol i processen.
Nøgleord: Kemi 8. klasse. Alle formler og definitioner, symboler for fysiske størrelser, måleenheder, præfikser til betegnelse af måleenheder, forhold mellem enheder, kemiske formler, grundlæggende definitioner, kort, tabeller, diagrammer.
1. Symboler, navne og måleenheder
nogle fysiske mængder brugt i kemi
| Fysisk mængde | Betegnelse | Enhed |
| Tid | t | Med |
| Tryk | s | Pa, kPa |
| Mængde af stof | ν | muldvarp |
| Masse af stof | m | kg, g |
| Massefraktion | ω | Dimensionsløs |
| Molar masse | M | kg/mol, g/mol |
| Molært volumen | Vn | m 3 /mol, l/mol |
| Volumen af stof | V | m 3, l |
| Volumenbrøk | Dimensionsløs | |
| Relativ atommasse | A r | Dimensionsløs |
| Hr | Dimensionsløs | |
| Relativ massefylde af gas A til gas B | D B (A) | Dimensionsløs |
| Densitet af stof | R | kg/m 3, g/cm 3, g/ml |
| Avogadros konstant | N A | 1/mol |
| Absolut temperatur | T | K (Kelvin) |
| Temperatur i Celsius | t | °C (grader Celsius) |
| Termisk effekt af en kemisk reaktion | Q | kJ/mol |

2. Relationer mellem enheder af fysiske størrelser

3. Kemiske formler i 8. klasse
4. Grundlæggende definitioner i 8. klasse

- Atom- den mindste kemisk udelelige partikel af et stof.
- Kemisk grundstof- en bestemt type atom.
- Molekyle- den mindste partikel af et stof, der bevarer sin sammensætning og kemiske egenskaber og består af atomer.
- Simple stoffer- stoffer, hvis molekyler består af atomer af samme type.
- Komplekse stoffer- stoffer, hvis molekyler består af atomer af forskellige typer.
- Kvalitativ sammensætning af stoffet viser hvilke atomer af grundstoffer den består af.
- Kvantitativ sammensætning af stoffet viser antallet af atomer af hvert grundstof i dets sammensætning.
- Kemisk formel- en konventionel registrering af et stofs kvalitative og kvantitative sammensætning ved hjælp af kemiske symboler og indekser.
- Atommasseenhed(amu) - en måleenhed for atommasse, lig med massen af 1/12 af et kulstofatom 12 C.
- Muldvarp- mængden af et stof, der indeholder et antal partikler svarende til antallet af atomer i 0,012 kg kulstof 12 C.
- Avogadros konstant (Na = 6*10 23 mol -1) - antallet af partikler indeholdt i en mol.
- Molær masse af et stof (M ) er massen af et stof taget i en mængde på 1 mol.
- Relativ atommasse element EN r - forholdet mellem massen af et atom af et givet grundstof m 0 til 1/12 af massen af et carbonatom 12 C.
- Relativ molekylvægt stoffer M r - forholdet mellem massen af et molekyle af et givet stof og 1/12 af massen af et kulstofatom 12 C. Den relative molekylmasse er lig med summen af de relative atommasser af de kemiske grundstoffer, der danner forbindelsen, idet tage højde for antallet af atomer i et givet grundstof.
- Massefraktion kemisk element ω(X) viser, hvilken del af den relative molekylmasse af stof X, der står for et givet grundstof.
ATOMMOLEKYLÆR UNDERVISNING
1. Der er stoffer med molekylær og ikke-molekylær struktur.
2. Der er mellemrum mellem molekylerne, hvis størrelse afhænger af stoffets aggregeringstilstand og temperatur.
3. Molekyler er i kontinuerlig bevægelse.
4. Molekyler er opbygget af atomer.
6. Atomer er karakteriseret ved en vis masse og størrelse.
Under fysiske fænomener bevares molekyler under kemiske fænomener, som regel ødelægges de. Atomer omarrangeres under kemiske fænomener og danner molekyler af nye stoffer.

LOV OM KONSTANT SAMMENSÆTNING AF STOFFER
Hvert kemisk rent stof med molekylær struktur, uanset fremstillingsmetoden, har en konstant kvalitativ og kvantitativ sammensætning.
VALENS
Valens er egenskaben for et atom i et kemisk grundstof til at vedhæfte eller erstatte et vist antal atomer af et andet grundstof.

KEMISK REAKTION
En kemisk reaktion er et fænomen, som resulterer i, at andre stoffer dannes af et stof. Reaktanter er stoffer, der indgår i en kemisk reaktion. Reaktionsprodukter er stoffer, der dannes som følge af en reaktion.
Tegn på kemiske reaktioner:
1. Frigivelse af varme (lys).
2. Skift i farve.
3. Lugt vises.
4. Dannelse af sediment.
5. Gasudløsning.




 V m= 22,4 l/mol (n.s.)
V m= 22,4 l/mol (n.s.)