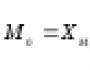साध्या पदार्थाच्या एकत्रीकरणाची अवस्था म्हणजे ओझोन. ओझोन: विषबाधा झाल्यास मानवांवर प्रभाव आणि कृती
ओझोनचे सूत्र काय आहे? या रसायनाची विशिष्ट वैशिष्ट्ये ओळखण्यासाठी एकत्र प्रयत्न करूया.
ऑक्सिजनचे ऍलोट्रॉपिक बदल
रसायनशास्त्रातील ओझोनचे आण्विक सूत्र O 3 . त्याचे सापेक्ष आण्विक वजन 48 आहे. कंपाऊंडमध्ये तीन O अणू असतात. ऑक्सिजन आणि ओझोनच्या सूत्रामध्ये समान रासायनिक घटक समाविष्ट असल्याने, त्यांना रसायनशास्त्रात अॅलोट्रॉपिक बदल म्हणतात.
भौतिक गुणधर्म
सामान्य परिस्थितीत, ओझोनचे रासायनिक सूत्र एक विशिष्ट गंध आणि हलका निळा रंग असलेला वायू पदार्थ आहे. निसर्गात, गडगडाटी वादळानंतर पाइनच्या जंगलातून फिरताना हे रासायनिक संयुग जाणवू शकते. ओझोनचे सूत्र O 3 असल्याने ते ऑक्सिजनपेक्षा 1.5 पट जड आहे. O 2 च्या तुलनेत ओझोनची विद्राव्यता खूप जास्त आहे. शून्य तापमानात, त्यातील 49 खंड 100 पाण्यात सहज विरघळतात. लहान एकाग्रतेमध्ये, पदार्थात विषारीपणाची मालमत्ता नसते, ओझोन हे केवळ लक्षणीय प्रमाणात विष आहे. हवेतील O 3 च्या प्रमाणाच्या 5% जास्तीत जास्त स्वीकार्य एकाग्रता मानली जाते. मजबूत कूलिंगच्या बाबतीत, ते सहजपणे द्रव बनते आणि जेव्हा तापमान -192 अंशांपर्यंत खाली येते तेव्हा ते घन बनते.

निसर्गात
ओझोन रेणू, ज्याचे सूत्र वर सादर केले गेले होते, ते ऑक्सिजनमधून विजेच्या स्त्राव दरम्यान निसर्गात तयार होते. याव्यतिरिक्त, O 3 शंकूच्या आकाराचे रेझिनच्या ऑक्सिडेशन दरम्यान तयार होते, ते हानिकारक सूक्ष्मजीव नष्ट करते आणि मानवांसाठी फायदेशीर मानले जाते.
प्रयोगशाळेत प्राप्त करणे
आपण ओझोन कसे मिळवू शकता? एक पदार्थ ज्याचे सूत्र O 3 आहे कोरड्या ऑक्सिजनमधून विद्युत स्त्राव पास करून तयार होतो. प्रक्रिया एका विशेष उपकरणात चालते - ओझोनेटर. हे दोन काचेच्या नळ्यांवर आधारित आहे जे एक दुसर्यामध्ये घातले जातात. आत एक धातूची रॉड आहे, बाहेर एक सर्पिल आहे. उच्च व्होल्टेज कॉइलला जोडल्यानंतर, बाहेरील आणि आतील नळ्यांमध्ये एक स्त्राव होतो आणि ऑक्सिजनचे ओझोनमध्ये रूपांतर होते. एक घटक ज्याचे सूत्र सहसंयोजक ध्रुवीय बंधनासह संयुग म्हणून सादर केले जाते ते ऑक्सिजनच्या ऍलोट्रॉपीची पुष्टी करते.
ऑक्सिजनचे ओझोनमध्ये रूपांतर करण्याची प्रक्रिया ही एक एंडोथर्मिक प्रतिक्रिया आहे ज्यामध्ये महत्त्वपूर्ण ऊर्जा खर्च समाविष्ट असतो. या परिवर्तनाच्या उलटक्षमतेमुळे, ओझोनचे विघटन दिसून येते, जे प्रणालीच्या उर्जेमध्ये घट होते.

रासायनिक गुणधर्म
ओझोनचे सूत्र त्याची ऑक्सिडायझिंग शक्ती स्पष्ट करते. ऑक्सिजन अणू गमावताना ते विविध पदार्थांशी संवाद साधण्यास सक्षम आहे. उदाहरणार्थ, जलीय माध्यमात पोटॅशियम आयोडाइडच्या प्रतिक्रियेत, ऑक्सिजन सोडला जातो आणि मुक्त आयोडीन तयार होते.
ओझोनचे आण्विक सूत्र जवळजवळ सर्व धातूंवर प्रतिक्रिया देण्याची क्षमता स्पष्ट करते. अपवाद सोने आणि प्लॅटिनम आहेत. उदाहरणार्थ, ओझोनमधून धातूचे चांदी पार केल्यानंतर, त्याचे काळेपणा दिसून येतो (ऑक्साइड तयार होतो). या मजबूत ऑक्सिडायझिंग एजंटच्या कृती अंतर्गत, रबराचा नाश दिसून येतो.
स्ट्रॅटोस्फियरमध्ये, सूर्यापासून अतिनील किरणोत्सर्गाच्या क्रियेमुळे ओझोन तयार होतो, ओझोन थर तयार होतो. हे कवच ग्रहाच्या पृष्ठभागाचे सौर किरणोत्सर्गाच्या नकारात्मक प्रभावापासून संरक्षण करते.

शरीरावर जैविक प्रभाव
या वायू पदार्थाची वाढलेली ऑक्सिडायझिंग क्षमता, मुक्त ऑक्सिजन रॅडिकल्सची निर्मिती मानवी शरीरासाठी त्याचा धोका दर्शवते. ओझोन व्यक्तीला काय हानी पोहोचवू शकते? हे श्वसनाच्या अवयवांच्या ऊतींना नुकसान आणि त्रास देते.
ओझोन रक्तातील कोलेस्टेरॉलवर कार्य करते, ज्यामुळे एथेरोस्क्लेरोसिस होतो. ओझोनची वाढीव एकाग्रता असलेल्या वातावरणात एखाद्या व्यक्तीच्या दीर्घकाळ राहिल्यास, पुरुष वंध्यत्व विकसित होते.
आपल्या देशात, हा ऑक्सिडायझिंग एजंट हानिकारक पदार्थांच्या पहिल्या (धोकादायक) वर्गाशी संबंधित आहे. त्याची सरासरी दैनिक MPC 0.03 mg प्रति घनमीटर पेक्षा जास्त नसावी.
ओझोनची विषाक्तता, जीवाणू आणि मूस नष्ट करण्यासाठी त्याचा वापर करण्याची शक्यता, निर्जंतुकीकरणासाठी सक्रियपणे वापरली जाते. अतिनील किरणोत्सर्गापासून पृथ्वीवरील जीवनासाठी स्ट्रॅटोस्फेरिक ओझोन एक उत्कृष्ट संरक्षणात्मक स्क्रीन आहे.

ओझोनचे फायदे आणि हानी याबद्दल
हा पदार्थ पृथ्वीच्या वातावरणाच्या दोन थरांमध्ये आढळतो. ट्रोपोस्फेरिक ओझोन सजीवांसाठी धोकादायक आहे, त्याचा पिकांवर, झाडांवर नकारात्मक परिणाम होतो आणि शहरी धुक्याचा एक घटक आहे. स्ट्रॅटोस्फेरिक ओझोन एखाद्या व्यक्तीला विशिष्ट फायदा आणतो. त्याचे जलीय द्रावणातील विघटन pH, तापमान आणि माध्यमाच्या गुणवत्तेवर अवलंबून असते. वैद्यकीय व्यवहारात, विविध सांद्रतेचे ओझोनाइज्ड पाणी वापरले जाते. ओझोन थेरपीमध्ये या पदार्थाचा मानवी शरीराशी थेट संपर्क समाविष्ट असतो. हे तंत्र पहिल्यांदा एकोणिसाव्या शतकात वापरले गेले. अमेरिकन संशोधकांनी हानिकारक सूक्ष्मजीवांचे ऑक्सिडायझेशन करण्यासाठी ओझोनच्या क्षमतेचे विश्लेषण केले आणि डॉक्टरांनी सर्दीच्या उपचारात हा पदार्थ वापरण्याची शिफारस केली.
आपल्या देशात, ओझोन थेरपीचा वापर गेल्या शतकाच्या शेवटीच होऊ लागला. उपचारात्मक हेतूंसाठी, हा ऑक्सिडायझिंग एजंट मजबूत बायोरेग्युलेटरची वैशिष्ट्ये प्रदर्शित करतो, जो पारंपारिक पद्धतींची प्रभावीता वाढविण्यास सक्षम आहे, तसेच एक प्रभावी स्वतंत्र एजंट म्हणून स्वतःला सिद्ध करण्यास सक्षम आहे. ओझोन थेरपी तंत्रज्ञानाच्या विकासानंतर, डॉक्टरांना अनेक रोगांचा प्रभावीपणे सामना करण्याची संधी आहे. न्यूरोलॉजी, दंतचिकित्सा, स्त्रीरोग, थेरपी, तज्ञ विविध प्रकारच्या संक्रमणांशी लढण्यासाठी या पदार्थाचा वापर करतात. ओझोन थेरपी पद्धतीची साधेपणा, त्याची प्रभावीता, उत्कृष्ट सहिष्णुता, कोणतेही दुष्परिणाम आणि कमी खर्चाद्वारे वैशिष्ट्यीकृत आहे.

निष्कर्ष
ओझोन हा एक मजबूत ऑक्सिडायझिंग एजंट आहे जो हानिकारक सूक्ष्मजंतूंशी लढण्यास सक्षम आहे. आधुनिक औषधांमध्ये ही मालमत्ता मोठ्या प्रमाणावर वापरली जाते. घरगुती थेरपीमध्ये, ओझोनचा वापर दाहक-विरोधी, इम्युनोमोड्युलेटरी, अँटीव्हायरल, जीवाणूनाशक, अँटी-स्ट्रेस, सायटोस्टॅटिक एजंट म्हणून केला जातो. ऑक्सिजन चयापचय विकार पुनर्संचयित करण्याच्या क्षमतेमुळे, ते उपचारात्मक आणि रोगप्रतिबंधक औषधांसाठी उत्कृष्ट संधी देते.
या कंपाऊंडच्या ऑक्सिडायझिंग क्षमतेवर आधारित नाविन्यपूर्ण पद्धतींपैकी, आम्ही या पदार्थाच्या इंट्रामस्क्यूलर, इंट्राव्हेनस, त्वचेखालील प्रशासनावर प्रकाश टाकतो. उदाहरणार्थ, ऑक्सिजन आणि ओझोनच्या मिश्रणाने बेडसोर्स, बुरशीजन्य त्वचेचे घाव, जळजळ यांचे उपचार प्रभावी तंत्र म्हणून ओळखले जातात.
उच्च सांद्रता मध्ये, ओझोन हेमोस्टॅटिक एजंट म्हणून वापरले जाऊ शकते. कमी एकाग्रतेमध्ये, ते दुरुस्ती, उपचार, एपिथेलायझेशनला प्रोत्साहन देते. हा पदार्थ, खारट मध्ये विसर्जित, जबडा पुनर्वसन एक उत्कृष्ट साधन आहे. आधुनिक युरोपियन औषधांमध्ये, लहान आणि मोठ्या ऑटोहेमोथेरपी व्यापक बनली आहे. दोन्ही पद्धती शरीरात ओझोनच्या प्रवेशाशी संबंधित आहेत, त्याची ऑक्सिडायझिंग क्षमता वापरून.
मोठ्या ऑटोहेमोथेरपीच्या बाबतीत, दिलेल्या एकाग्रतेसह ओझोन द्रावण रुग्णाच्या शिरामध्ये इंजेक्शनने दिले जाते. लहान ऑटोहेमोथेरपी ओझोनेटेड रक्ताच्या इंट्रामस्क्यूलर इंजेक्शनद्वारे दर्शविली जाते. औषधाव्यतिरिक्त, या मजबूत ऑक्सिडायझिंग एजंटला रासायनिक उत्पादनात मागणी आहे.
मॉस्को, 16 सप्टेंबर - RIA नोवोस्ती.ओझोन थराच्या संरक्षणासाठी आंतरराष्ट्रीय दिवस, सूर्याच्या हानिकारक अल्ट्राव्हायोलेट किरणोत्सर्गापासून पृथ्वीवरील सर्व जीवनाचे संरक्षण करणारी पातळ "ढाल", सोमवार, 16 सप्टेंबर रोजी साजरा केला जातो - या दिवशी 1987 मध्ये प्रसिद्ध मॉन्ट्रियल प्रोटोकॉलवर स्वाक्षरी करण्यात आली होती.
सामान्य परिस्थितीत, ओझोन, किंवा O3, एक फिकट निळा वायू आहे जो थंड होताना गडद निळा द्रव आणि नंतर निळ्या-काळ्या क्रिस्टल्समध्ये बदलतो. एकूण, ग्रहाच्या वातावरणातील ओझोनचे प्रमाण 0.6 भाग प्रति दशलक्ष आहे: याचा अर्थ, उदाहरणार्थ, वातावरणाच्या प्रत्येक क्यूबिक मीटरमध्ये फक्त 0.6 घन सेंटीमीटर ओझोन आहे. तुलनेसाठी, वातावरणातील कार्बन डाय ऑक्साईड आधीच सुमारे 400 भाग प्रति दशलक्ष आहे - म्हणजे, हवेच्या समान घनमीटर प्रति दोन ग्लासपेक्षा जास्त.
खरं तर, ओझोनच्या इतक्या लहान एकाग्रतेला पृथ्वीसाठी वरदान म्हटले जाऊ शकते: हा वायू, जो 15-30 किलोमीटरच्या उंचीवर बचत ओझोन थर बनवतो, एखाद्या व्यक्तीच्या जवळच्या परिसरात खूपच कमी "उदात्त" असतो. ओझोन, रशियन वर्गीकरणानुसार, सर्वोच्च, प्रथम श्रेणीतील धोक्याच्या पदार्थांशी संबंधित आहे - हे एक अतिशय मजबूत ऑक्सिडायझिंग एजंट आहे, जे मानवांसाठी अत्यंत विषारी आहे.
ओझोन थर जतन करण्यासाठी आंतरराष्ट्रीय दिवस1994 मध्ये, यूएन जनरल असेंब्लीने 16 सप्टेंबर हा ओझोन थर संरक्षणासाठी आंतरराष्ट्रीय दिवस म्हणून घोषित केला. या दिवशी 1987 मध्ये, ओझोन थर कमी करणाऱ्या पदार्थांवरील मॉन्ट्रियल प्रोटोकॉलवर स्वाक्षरी करण्यात आली.कॅटालिसिस आणि गॅस इलेक्ट्रोकेमिस्ट्री, रसायनशास्त्र विद्याशाखा, लोमोनोसोव्ह मॉस्को स्टेट युनिव्हर्सिटीच्या प्रयोगशाळेतील वरिष्ठ संशोधक वदिम सामोइलोविच यांनी कठीण ओझोनचे विविध गुणधर्म समजून घेण्यासाठी आरआयए नोवोस्तीला मदत केली.
ओझोन ढाल
"हा एक चांगला अभ्यास केलेला वायू आहे, जवळजवळ प्रत्येक गोष्टीचा अभ्यास केला गेला आहे - सर्वकाही कधीच घडत नाही, परंतु मुख्य सर्वकाही (ज्ञात आहे) ... ओझोनमध्ये अनेक प्रकारचे अनुप्रयोग आहेत. परंतु हे विसरू नका की, सर्वसाधारणपणे बोलणे, जीवन उद्भवले. ओझोन थराबद्दल धन्यवाद - हा कदाचित मुख्य क्षण आहे," समॉयलोविच म्हणतात.
स्ट्रॅटोस्फियरमध्ये, फोटोकेमिकल प्रतिक्रियांच्या परिणामी ऑक्सिजनपासून ओझोन तयार होतो - अशा प्रतिक्रिया सौर किरणोत्सर्गाच्या प्रभावाखाली सुरू होतात. तेथे, ओझोनची एकाग्रता आधीच जास्त आहे - सुमारे 8 मिलीलीटर प्रति घनमीटर. जेव्हा ते विशिष्ट संयुगे "मिळते" तेव्हा वायू नष्ट होतो, उदाहरणार्थ, अणु क्लोरीन आणि ब्रोमिन - हेच पदार्थ धोकादायक क्लोरोफ्लोरोकार्बन्सचा भाग आहेत, ज्यांना फ्रीॉन म्हणून ओळखले जाते. मॉन्ट्रियल प्रोटोकॉलच्या आगमनापूर्वी, ते इतरांसह, रेफ्रिजरेशन उद्योगात आणि गॅस काडतुसेमध्ये प्रणोदक म्हणून वापरले जात होते.
ओझोन थराच्या संरक्षणासाठी प्रोटोकॉलने हे कार्य पूर्ण केले, असे शास्त्रज्ञांचे म्हणणे आहेमॉन्ट्रियल प्रोटोकॉलने त्याचे कार्य पूर्ण केले आहे - निरीक्षणे दर्शविते की वातावरणातील ओझोन कमी करणाऱ्या पदार्थांची सामग्री कमी होत आहे आणि कराराच्या मदतीने, वैज्ञानिक समुदायाने ओझोनशी संबंधित वातावरणातील प्रक्रिया समजून घेण्यात मोठी प्रगती केली आहे. स्तर, आंतरराष्ट्रीय ओझोन आयोगातील रशियाचे प्रतिनिधी, एक अग्रगण्य संशोधक, ओबुखोव्ह अलेक्झांडर ग्रुझदेव यांच्या नावावर असलेल्या रशियन अकादमी ऑफ सायन्सेसच्या आरआयए नोवोस्टी इन्स्टिट्यूट ऑफ अॅटमॉस्फेरिक फिजिक्सला सांगितले.2012 मध्ये, जेव्हा मॉन्ट्रियल प्रोटोकॉलने 25 वा वर्धापन दिन साजरा केला तेव्हा, संयुक्त राष्ट्र पर्यावरण कार्यक्रम (UNEP) च्या तज्ञांनी ओझोन थराच्या संरक्षणास केवळ चार प्रमुख पर्यावरणीय समस्यांपैकी एक म्हणून नाव दिले ज्यामध्ये मानवजातीने लक्षणीय प्रगती केली आहे. त्याच वेळी, यूएनईपीने नमूद केले की 1998 पासून स्ट्रॅटोस्फियरमधील ओझोन सामग्री कमी होणे थांबले आहे आणि शास्त्रज्ञांच्या मते, 2050-2075 पर्यंत ते 1980 पूर्वी नोंदलेल्या पातळीवर परत येऊ शकेल.
ओझोन धुके
पृथ्वीच्या पृष्ठभागापासून 30 किलोमीटर अंतरावर, ओझोन चांगले "वर्तन" करते, परंतु ट्रोपोस्फियरमध्ये, पृष्ठभागाचा थर, तो धोकादायक प्रदूषक असल्याचे दिसून येते. UNEP च्या मते, उत्तर गोलार्धातील ट्रोपोस्फेरिक ओझोन सांद्रता गेल्या 100 वर्षांत जवळजवळ तिप्पट झाली आहे, ज्यामुळे तो तिसरा सर्वात मोठा "मानववंशीय" हरितगृह वायू बनला आहे.
येथे देखील, ओझोन वातावरणात उत्सर्जित होत नाही, परंतु हवेतील सौर किरणोत्सर्गाच्या प्रभावाखाली तयार होतो, जो आधीच ओझोन "पूर्ववर्ती" - नायट्रोजन ऑक्साईड्स, अस्थिर हायड्रोकार्बन्स आणि काही इतर संयुगे द्वारे प्रदूषित आहे. ज्या शहरांमध्ये ओझोन हा धुक्याचा मुख्य घटक आहे, तेथे वाहनांचे उत्सर्जन अप्रत्यक्षपणे त्याच्या दिसण्यासाठी "दोष" आहे.
जमिनीच्या पातळीच्या ओझोनचा त्रास फक्त लोक आणि हवामानच नाही. यूएनईपीचा अंदाज आहे की ट्रोपोस्फेरिक ओझोन कमी केल्याने सुमारे 25 दशलक्ष टन तांदूळ, गहू, सोयाबीन आणि कॉर्न या वनस्पती-विषारी वायूमुळे दरवर्षी गमावले जाणारे नुकसान वाचविण्यात मदत होऊ शकते.

हे तंतोतंत आहे कारण भू-स्तरीय ओझोन आता इतका उपयुक्त नाही की हवामान आणि पर्यावरण निरीक्षण विशेषज्ञ मॉस्कोसह मोठ्या शहरांच्या हवेत त्याच्या एकाग्रतेवर सतत लक्ष ठेवतात.
ओझोन उपयुक्त
"ओझोनचा एक अतिशय मनोरंजक गुणधर्म म्हणजे जीवाणूनाशक आहे. क्लोरीन, मॅंगनीज पेरोक्साईड, क्लोरीन ऑक्साईड अशा सर्व पदार्थांमध्ये ते व्यावहारिकदृष्ट्या पहिले आहे," वादिम समॉयलोविच म्हणतात.
ओझोनचा हाच टोकाचा स्वभाव, ज्यामुळे तो एक अतिशय मजबूत ऑक्सिडायझिंग एजंट बनतो, या वायूची व्याप्ती स्पष्ट करते. ओझोनचा वापर परिसर, कपडे, साधने आणि अर्थातच, पाणी शुद्धीकरण - पिण्याचे आणि औद्योगिक आणि अगदी कचरा दोन्ही निर्जंतुकीकरण आणि निर्जंतुकीकरणासाठी केले जाते.
याव्यतिरिक्त, तज्ञ जोर देतात की अनेक देशांमध्ये ओझोनचा वापर पल्प ब्लीचिंग प्लांटमध्ये क्लोरीनचा पर्याय म्हणून केला जातो.
"सेंद्रिय पदार्थांसह क्लोरीन (प्रतिक्रिया करताना) अनुक्रमे ऑर्गेनोक्लोरीन देते, जे फक्त क्लोरीनपेक्षा जास्त विषारी असतात. मोठ्या प्रमाणावर, हे (विषारी कचऱ्याचे स्वरूप - एड.) एकतर क्लोरीनची एकाग्रता झपाट्याने कमी करून टाळता येते, किंवा फक्त ते काढून टाकणे. पर्यायांपैकी एक - ओझोनने क्लोरीन बदलणे," समॉयलोविच यांनी स्पष्ट केले.
हवेचे ओझोनीकरण देखील केले जाऊ शकते आणि यामुळे मनोरंजक परिणाम देखील मिळतात - उदाहरणार्थ, इव्हानोव्होमध्ये, ऑल-रशियन रिसर्च इन्स्टिट्यूट ऑफ लेबर प्रोटेक्शनच्या तज्ञांनी आणि त्यांच्या सहकाऱ्यांनी अनेक अभ्यास केले, ज्या दरम्यान "काताच्या दुकानांमध्ये, विशिष्ट प्रमाणात ओझोन सामान्य वायुवीजन नलिकांमध्ये जोडले गेले." परिणामी, श्वसन रोगांचे प्रमाण कमी झाले, तर कामगार उत्पादकता, उलट, वाढली. अन्न गोदामांमध्ये एअर ओझोनेशनमुळे त्याची सुरक्षितता वाढू शकते आणि इतर देशांमध्येही असे अनुभव आहेत.
ओझोन विषारी आहे

ओझोनच्या वापरासह पकड समान आहे - त्याची विषाक्तता. रशियामध्ये, वातावरणातील हवेतील ओझोनसाठी जास्तीत जास्त अनुज्ञेय एकाग्रता (एमपीसी) 0.16 मिलीग्राम प्रति क्यूबिक मीटर आहे आणि कार्यरत क्षेत्राच्या हवेमध्ये - 0.1 मिलीग्राम आहे. म्हणून, समोयलोविच लक्षात घेतात, त्याच ओझोनेशनला सतत देखरेखीची आवश्यकता असते, जे प्रकरण मोठ्या प्रमाणात गुंतागुंत करते.
"हे अजूनही एक किचकट तंत्र आहे. तेथे काही जीवाणूनाशकाची बादली ओतणे, ते ओतणे खूप सोपे आहे आणि तेच आहे, परंतु येथे तुम्हाला अनुसरण करणे आवश्यक आहे, काही प्रकारची तयारी असणे आवश्यक आहे," शास्त्रज्ञ म्हणतात.
ओझोन मानवी शरीराला हळूहळू परंतु गंभीरपणे हानी पोहोचवते - ओझोन प्रदूषित हवेच्या दीर्घकाळापर्यंत संपर्कामुळे हृदय व रक्तवाहिन्यासंबंधी आणि श्वसन रोगांचा धोका वाढतो. कोलेस्टेरॉलवर प्रतिक्रिया देऊन, ते अघुलनशील संयुगे बनवते, ज्यामुळे एथेरोस्क्लेरोसिसचा विकास होतो.
"जास्तीत जास्त अनुज्ञेय पातळीपेक्षा जास्त प्रमाणात, डोकेदुखी, श्लेष्मल त्वचेची जळजळ, खोकला, चक्कर येणे, सामान्य थकवा आणि ह्रदयाचा क्रियाकलाप कमी होणे उद्भवू शकते. विषारी भू-स्तरीय ओझोनमुळे श्वसनाचे रोग दिसणे किंवा वाढणे, लहान मुले, वृद्ध आणि दम्याचे रुग्ण धोक्यात आहेत," रोशीड्रोमेटच्या सेंट्रल एरोलॉजिकल ऑब्झर्व्हेटरी (CAO) च्या वेबसाइटवर नमूद केले आहे.
ओझोन स्फोटक
ओझोन केवळ इनहेलसाठीच हानिकारक नाही - सामने देखील लपवले पाहिजेत, कारण हा वायू खूप स्फोटक आहे. पारंपारिकपणे, 300-350 मिलीलीटर प्रति लिटर हवेला ओझोन वायूच्या धोकादायक पातळीसाठी "थ्रेशोल्ड" मानले गेले आहे, जरी काही शास्त्रज्ञ उच्च पातळीसह काम करत आहेत, Samoylovich म्हणतात. परंतु द्रव ओझोन - तोच निळा द्रव जो थंड होताना गडद होतो - उत्स्फूर्तपणे स्फोट होतो.
रॉकेट इंधनात ऑक्सिडायझिंग एजंट म्हणून द्रव ओझोनचा वापर करण्यापासून हेच प्रतिबंधित करते - अशा कल्पना अंतराळ युग सुरू झाल्यानंतर लवकरच दिसू लागल्या.
"विद्यापीठातील आमची प्रयोगशाळा अशाच एका कल्पनेवर उभी राहिली. प्रत्येक रॉकेटच्या इंधनाचे प्रतिक्रियेत त्याचे स्वतःचे कॅलरीफिक मूल्य असते, म्हणजेच ते जळून जाते तेव्हा किती उष्णता सोडली जाते आणि त्यामुळे रॉकेट किती शक्तिशाली असेल. हे ज्ञात आहे की द्रव ओझोनमध्ये मिश्रित द्रव हायड्रोजन हा सर्वात शक्तिशाली पर्याय आहे… परंतु एक वजा आहे. द्रव ओझोनचा स्फोट होतो, आणि तो उत्स्फूर्तपणे स्फोट होतो, म्हणजे कोणत्याही उघड कारणाशिवाय," मॉस्को स्टेट युनिव्हर्सिटीचे प्रतिनिधी म्हणतात.
त्यांच्या म्हणण्यानुसार, सोव्हिएत आणि अमेरिकन दोन्ही प्रयोगशाळांनी "तो कसा तरी सुरक्षित (व्यवसाय) करण्यासाठी प्रचंड प्रयत्न आणि वेळ खर्च केला - असे दिसून आले की ते करणे अशक्य आहे." समोयलोविच आठवते की एके दिवशी यूएसए मधील सहकारी विशेषतः शुद्ध ओझोन मिळवण्यात यशस्वी झाले, जे "स्फोट होत नाही" असे दिसते, "प्रत्येकजण आधीच टिंपनी मारत होता", परंतु नंतर संपूर्ण वनस्पतीचा स्फोट झाला आणि काम थांबले.
“आमच्याकडे अशी प्रकरणे होती जेव्हा, द्रव ओझोनसह फ्लास्क उभा राहतो, उभा राहतो, त्यात द्रव नायट्रोजन ओतला जातो आणि नंतर - एकतर नायट्रोजन तेथे उकळला किंवा काहीतरी - तुम्ही या, परंतु अर्धी स्थापना तेथे नाही, सर्व काही धूळ उडून गेले आहे. का स्फोट झाला - कोणास ठाऊक," शास्त्रज्ञ नोट करतात.
पाऊस पडल्यानंतर श्वास घेणे किती आनंददायी असते हे तुम्ही कधी लक्षात घेतले आहे का? पावसानंतर येणार्या वातावरणातील ओझोनद्वारे ही ताजी हवा पुरविली जाते. हा पदार्थ काय आहे, त्याचे कार्य, सूत्र काय आहे आणि ते मानवी शरीरासाठी खरोखर उपयुक्त आहे का? चला ते बाहेर काढूया.
ओझोन म्हणजे काय?
हायस्कूलमध्ये शिकलेल्या प्रत्येकाला माहित आहे की ऑक्सिजन रेणूमध्ये ऑक्सिजन या रासायनिक घटकाचे दोन अणू असतात. तथापि, हा घटक आणखी एक रासायनिक संयुग तयार करण्यास सक्षम आहे - ओझोन. हे नाव अशा पदार्थाला दिले जाते जे, नियम म्हणून, वायूच्या स्वरूपात उद्भवते (जरी ते एकत्रीकरणाच्या तीनही अवस्थांमध्ये अस्तित्वात असू शकते).
या पदार्थाचा रेणू ऑक्सिजन (O 2) सारखाच आहे, परंतु त्यात दोन नसून तीन अणू आहेत - O 3.
ओझोनच्या शोधाचा इतिहास
ओझोनचे प्रथम संश्लेषण करणारा माणूस म्हणजे डच भौतिकशास्त्रज्ञ मार्टिन व्हॅन मारुम.

त्यानेच 1785 मध्ये हवेतून इलेक्ट्रिक डिस्चार्ज करून एक प्रयोग केला. परिणामी वायूने केवळ विशिष्ट वासच प्राप्त केला नाही तर निळसर रंगाची छटा देखील घेतली. याव्यतिरिक्त, नवीन पदार्थ सामान्य ऑक्सिजनपेक्षा मजबूत ऑक्सिडायझिंग एजंट असल्याचे दिसून आले. तर, पारावर त्याचा प्रभाव विचारात घेतल्यावर, व्हॅन मारमला आढळले की धातूने त्याचे भौतिक गुणधर्म किंचित बदलले आहेत, जे ऑक्सिजनच्या प्रभावाखाली घडले नाही.
त्याचा शोध असूनही, डच भौतिकशास्त्रज्ञाने ओझोन हा एक विशेष पदार्थ आहे यावर विश्वास ठेवला नाही. व्हॅन मारुमच्या शोधानंतर केवळ 50 वर्षांनी, जर्मन शास्त्रज्ञ ख्रिश्चन फ्रेडरिक शॉनबीन यांना ओझोनमध्ये गंभीरपणे रस निर्माण झाला. त्याच्यामुळेच या पदार्थाला त्याचे नाव मिळाले - ओझोन (ग्रीक शब्दाचा अर्थ "गंध" नंतर), आणि त्याचा अधिक बारकाईने अभ्यास आणि वर्णन केले गेले.
ओझोन: भौतिक गुणधर्म
या पदार्थात अनेक गुणधर्म आहेत. यापैकी पहिली ओझोनची क्षमता, पाण्यासारखी, एकत्रीकरणाच्या तीन अवस्थांमध्ये अस्तित्वात आहे.
सामान्य स्थिती ज्यामध्ये ओझोन राहतो तो निळसर वायू असतो (तोच आकाशाला निळसर रंग देतो) लक्षात येण्याजोगा धातूचा सुगंध असतो. अशा वायूची घनता 2.1445 g/dm³ आहे.
जेव्हा तापमान कमी होते, तेव्हा ओझोन रेणू 1.59 g/cm³ (-188 °C वर) घनतेसह निळा-व्हायलेट द्रव तयार करतात. द्रव O 3 -111.8 डिग्री सेल्सियस वर उकळते.
घन अवस्थेत असताना, ओझोन गडद होतो, वेगळ्या जांभळ्या-निळ्या प्रतिबिंबाने जवळजवळ काळा होतो. त्याची घनता 1.73 g/cm 3 (−195.7 ° С वर) आहे. ज्या तापमानात घन ओझोन वितळण्यास सुरुवात होते ते तापमान −197.2 °C असते.
O 3 चे आण्विक वजन 48 डाल्टन आहे.
0 डिग्री सेल्सिअस तापमानात, ओझोन पाण्यात पूर्णपणे विरघळतो, ऑक्सिजनपेक्षा दहापट वेगाने. पाण्यातील अशुद्धतेची उपस्थिती ही प्रतिक्रिया आणखी वाढवू शकते.
पाण्याव्यतिरिक्त, ओझोन फ्रीॉनमध्ये विरघळतो, ज्यामुळे त्याची वाहतूक सुलभ होते.
O 3 (एकत्रीकरणाच्या द्रव अवस्थेत) विरघळणे सोपे असलेल्या इतर पदार्थांमध्ये आर्गॉन, नायट्रोजन, फ्लोरिन, मिथेन, कार्बन डायऑक्साइड, कार्बन टेट्राक्लोराईड आहेत.
ते द्रव ऑक्सिजनमध्ये (93 के तापमानात) चांगले मिसळते.
ओझोनचे रासायनिक गुणधर्म
O 3 रेणू ऐवजी अस्थिर आहे. या कारणास्तव, सामान्य स्थितीत, ते 10-40 मिनिटे अस्तित्वात असते, त्यानंतर ते विघटित होते, थोड्या प्रमाणात उष्णता आणि ऑक्सिजन O 2 तयार करते. उत्प्रेरक सभोवतालच्या तापमानात वाढ किंवा वातावरणाचा दाब कमी झाल्यास ही प्रतिक्रिया अधिक जलद होऊ शकते. तसेच, ओझोनचे विघटन त्याच्या धातूंशी (सोने, प्लॅटिनम आणि इरिडियम वगळता), ऑक्साइड किंवा सेंद्रिय उत्पत्तीच्या पदार्थांच्या संपर्कामुळे होते.
नायट्रिक ऍसिडशी परस्परसंवाद O 3 चे विघटन थांबवते. -78 डिग्री सेल्सिअस तापमानात पदार्थाच्या साठवणुकीमुळे देखील हे सुलभ होते.
ओझोनचा मुख्य रासायनिक गुणधर्म म्हणजे त्याची ऑक्सिडायझेशन. ऑक्सिडेशनच्या उत्पादनांपैकी एक नेहमीच ऑक्सिजन असतो.
वेगवेगळ्या परिस्थितीत, O 3 जवळजवळ सर्व पदार्थ आणि रासायनिक घटकांशी संवाद साधण्यास सक्षम आहे, त्यांची विषारीता कमी करून त्यांना कमी धोकादायक घटकांमध्ये बदलते. उदाहरणार्थ, सायनाइड्स सायनेट्समध्ये ऑक्सिडाइझ केले जातात, जे जैविक जीवांसाठी अधिक सुरक्षित असतात.
ते कसे उत्खनन केले जातात?

बहुतेकदा, ओ 3 काढण्यासाठी, ऑक्सिजन विद्युत प्रवाहाने प्रभावित होतो. ऑक्सिजन आणि ओझोनचे परिणामी मिश्रण वेगळे करण्यासाठी, नंतरच्या गुणधर्माचा वापर O 2 पेक्षा चांगले द्रवीकरण करण्यासाठी केला जातो.
रासायनिक प्रयोगशाळांमध्ये, कधीकधी O 3 बेरियम पेरोक्साइडसह थंड केलेल्या सल्फ्यूरिक ऍसिडच्या प्रतिक्रियेद्वारे तयार केले जाते.
रूग्णांच्या पुनर्प्राप्तीसाठी ओ 3 वापरणार्या वैद्यकीय संस्थांमध्ये, हा पदार्थ अल्ट्राव्हायोलेट प्रकाशासह ओ 2 चे विकिरण करून प्राप्त केला जातो (तसे, हा पदार्थ सूर्यप्रकाशाच्या प्रभावाखाली पृथ्वीच्या वातावरणात त्याच प्रकारे तयार होतो).
औषध आणि उद्योगात O3 चा वापर
ओझोनची साधी रचना, त्याच्या उत्खननासाठी स्त्रोत सामग्रीची उपलब्धता उद्योगात या पदार्थाच्या सक्रिय वापरास हातभार लावते.
एक मजबूत ऑक्सिडायझिंग एजंट असल्याने, ते कमी विषारी असताना क्लोरीन, फॉर्मल्डिहाइड किंवा इथिलीन ऑक्साईडपेक्षा बरेच चांगले निर्जंतुक करण्यास सक्षम आहे. म्हणून, O 3 चा उपयोग वैद्यकीय उपकरणे, उपकरणे, गणवेश आणि अनेक औषधे निर्जंतुक करण्यासाठी केला जातो.

उद्योगात, हा पदार्थ बहुतेकदा अनेक रसायनांच्या शुद्धीकरणासाठी किंवा काढण्यासाठी वापरला जातो.
वापरण्याची दुसरी शाखा म्हणजे कागद, फॅब्रिक्स, खनिज तेलांचे ब्लीचिंग.
रासायनिक उद्योगात, O 3 केवळ उपकरणे, साधने आणि कंटेनर निर्जंतुक करण्यात मदत करत नाही तर स्वतः उत्पादने (अंडी, धान्य, मांस, दूध) निर्जंतुक करण्यासाठी आणि त्यांचे शेल्फ लाइफ वाढवण्यासाठी देखील वापरले जाते. खरं तर, हे सर्वोत्कृष्ट अन्न संरक्षकांपैकी एक मानले जाते कारण ते गैर-विषारी आणि गैर-कार्सिनोजेनिक आहे, आणि ते मोल्ड स्पोर्स आणि इतर बुरशी आणि जीवाणू मारण्यासाठी देखील उत्कृष्ट आहे.

बेकरीमध्ये, यीस्ट किण्वन प्रक्रियेला गती देण्यासाठी ओझोनचा वापर केला जातो.
तसेच, O 3 च्या मदतीने, कॉग्नेक्स कृत्रिमरित्या वृद्ध आहेत, आणि फॅटी तेल शुद्ध केले जातात.
ओझोनचा मानवी शरीरावर कसा परिणाम होतो?
ऑक्सिजनच्या या समानतेमुळे, ओझोन हा मानवी शरीरासाठी फायदेशीर पदार्थ आहे असा गैरसमज आहे. तथापि, असे होत नाही, कारण O 3 हे सर्वात मजबूत ऑक्सिडायझिंग एजंट्सपैकी एक आहे जे फुफ्फुसांना नष्ट करू शकते आणि जो हा वायू जास्त प्रमाणात श्वास घेतो त्याला मारू शकतो. प्रत्येक देशातील राज्य पर्यावरण संस्था वातावरणातील ओझोनच्या एकाग्रतेचे काटेकोरपणे निरीक्षण करतात यात आश्चर्य नाही.
जर ओझोन इतका वाईट असेल तर पावसानंतर श्वास घेणे नेहमीच सोपे का होते?

वस्तुस्थिती अशी आहे की O 3 च्या गुणधर्मांपैकी एक म्हणजे जीवाणू मारण्याची आणि हानिकारक अशुद्धतेपासून पदार्थ शुद्ध करण्याची क्षमता आहे. जेव्हा पाऊस पडतो तेव्हा वादळामुळे ओझोन तयार होऊ लागतो. हा वायू हवेत असलेल्या विषारी पदार्थांवर परिणाम करतो, त्यांचे विभाजन करतो आणि या अशुद्धतेपासून ऑक्सिजन शुद्ध करतो. या कारणास्तव पावसानंतरची हवा इतकी ताजी आणि आल्हाददायक असते आणि आकाश एक सुंदर आकाशी रंग घेते.
ओझोनचे हे रासायनिक गुणधर्म, जे त्यास हवा शुद्ध करण्यास अनुमती देतात, अलीकडेच विविध श्वसन रोगांनी ग्रस्त लोकांवर उपचार करण्यासाठी तसेच हवा, पाणी आणि विविध कॉस्मेटिक प्रक्रियांच्या शुद्धीकरणासाठी सक्रियपणे वापरले गेले आहेत.
आज अतिशय सक्रियपणे, घरगुती ओझोनायझर्सची जाहिरात केली जाते जे या गॅसच्या मदतीने घरातील हवा शुद्ध करतात. जरी हे तंत्र खूप प्रभावी वाटत असले तरी, आतापर्यंत शास्त्रज्ञांनी शरीरावर मोठ्या प्रमाणात ओझोन शुद्ध केलेल्या हवेच्या प्रभावाचा पुरेसा अभ्यास केलेला नाही. या कारणास्तव, आपण ओझोनेशनसह खूप वाहून जाऊ नये.
ओझोनचे भौतिक गुणधर्म अतिशय वैशिष्ट्यपूर्ण आहेत: हा सहज स्फोट होणारा निळा वायू आहे. एक लिटर ओझोनचे वजन अंदाजे 2 ग्रॅम असते, तर हवेचे वजन 1.3 ग्रॅम असते. त्यामुळे ओझोन हवेपेक्षा जड आहे. ओझोनचा वितळण्याचा बिंदू उणे 192.7ºС आहे. हा "वितळलेला" ओझोन एक गडद निळा द्रव आहे. ओझोन "बर्फ" मध्ये जांभळ्या रंगाचा गडद निळा रंग असतो आणि 1 मिमी पेक्षा जास्त जाडीने अपारदर्शक बनतो. ओझोनचा उत्कलन बिंदू उणे 112ºС आहे. वायू स्थितीत, ओझोन डायमॅग्नेटिक आहे, म्हणजे. त्यात चुंबकीय गुणधर्म नसतात आणि द्रव अवस्थेत ते कमकुवतपणे पॅरामॅग्नेटिक असते. वितळलेल्या पाण्यात ओझोनची विद्राव्यता ऑक्सिजनपेक्षा 15 पट जास्त आहे आणि अंदाजे 1.1 g/l आहे. एक लिटर ऍसिटिक ऍसिड खोलीच्या तपमानावर 2.5 ग्रॅम ओझोन विरघळते. हे आवश्यक तेले, टर्पेन्टाइन, कार्बन टेट्राक्लोराईडमध्ये देखील चांगले विरघळते. ओझोनचा वास 15 µg/m3 हवेच्या वरील एकाग्रतेवर जाणवतो. कमीतकमी एकाग्रतेमध्ये, ते "ताजेपणाचा वास" म्हणून समजले जाते, उच्च एकाग्रतेमध्ये ती तीव्र चिडचिड करते.
ओझोन खालील सूत्रानुसार ऑक्सिजनपासून तयार होतो: 3O2 + 68 kcal → 2O3. ओझोन निर्मितीची शास्त्रीय उदाहरणे: गडगडाटी वादळादरम्यान विजेच्या कृती अंतर्गत; वरच्या वातावरणात सूर्यप्रकाशाच्या संपर्कात. अणू ऑक्सिजन सोडण्याच्या कोणत्याही प्रक्रियेदरम्यान, उदाहरणार्थ, हायड्रोजन पेरोक्साईडच्या विघटनादरम्यान ओझोन देखील तयार होऊ शकतो. ओझोनचे औद्योगिक संश्लेषण कमी तापमानात इलेक्ट्रिकल डिस्चार्जच्या वापराशी संबंधित आहे. ओझोन निर्मितीचे तंत्रज्ञान एकमेकांपासून भिन्न असू शकतात. म्हणून, वैद्यकीय हेतूंसाठी वापरला जाणारा ओझोन मिळविण्यासाठी, केवळ शुद्ध (अशुद्धता नसलेला) वैद्यकीय ऑक्सिजन वापरला जातो. ऑक्सिजनच्या अशुद्धतेपासून तयार झालेले ओझोन वेगळे करणे सामान्यतः भौतिक गुणधर्मांमधील फरकांमुळे कठीण नसते (ओझोन अधिक सहजपणे द्रव बनते). प्रतिक्रियेचे काही गुणात्मक आणि परिमाणवाचक मापदंड आवश्यक नसल्यास, ओझोन मिळविण्यात कोणत्याही विशिष्ट अडचणी येत नाहीत.
O3 रेणू अस्थिर आहे आणि उष्णतेच्या सुटकेसह ते त्वरीत O2 मध्ये बदलते. कमी एकाग्रतेमध्ये आणि परदेशी अशुद्धतेशिवाय, ओझोन हळूहळू विघटित होते, उच्च एकाग्रतेवर - स्फोटासह. अल्कोहोल त्याच्या संपर्कात असताना त्वरित प्रज्वलित होते. ऑक्सिडेशन सब्सट्रेट (सेंद्रिय पदार्थ, काही धातू किंवा त्यांचे ऑक्साईड) अगदी नगण्य प्रमाणात ओझोनचे गरम करणे आणि संपर्क केल्याने त्याचे विघटन झपाट्याने होते. स्टॅबिलायझर (थोड्या प्रमाणात HNO3) च्या उपस्थितीत -78ºС वर तसेच काचेच्या, काही प्लास्टिक किंवा मौल्यवान धातूंच्या भांड्यात ओझोन दीर्घकाळ साठवले जाऊ शकते.
ओझोन सर्वात मजबूत ऑक्सिडायझिंग एजंट आहे. या घटनेचे कारण क्षय प्रक्रियेत अणू ऑक्सिजन तयार होते या वस्तुस्थितीत आहे. असा ऑक्सिजन आण्विक ऑक्सिजनपेक्षा जास्त आक्रमक असतो, कारण ऑक्सिजन रेणूमध्ये आण्विक कक्षेच्या एकत्रित वापरामुळे बाह्य स्तरावर इलेक्ट्रॉनची कमतरता फारशी लक्षात येत नाही.
18 व्या शतकात, हे लक्षात आले की ओझोनच्या उपस्थितीत पारा त्याची चमक गमावतो आणि काचेला चिकटतो; ऑक्सिडाइज्ड आणि जेव्हा ओझोन पोटॅशियम आयोडाइडच्या जलीय द्रावणातून जातो तेव्हा वायूयुक्त आयोडीन बाहेर पडू लागते. शुद्ध ऑक्सिजनसह समान "युक्त्या" कार्य करत नाहीत. त्यानंतर, ओझोनचे गुणधर्म शोधले गेले, जे मानवजातीने ताबडतोब स्वीकारले: ओझोन एक उत्कृष्ट पूतिनाशक बनला, ओझोनने पाण्यापासून कोणत्याही उत्पत्तीचे सेंद्रिय पदार्थ (परफ्यूम आणि सौंदर्यप्रसाधने, जैविक द्रव) त्वरीत काढून टाकले, उद्योगात मोठ्या प्रमाणावर वापरले जाऊ लागले आणि दैनंदिन जीवनात, आणि डेंटल ड्रिलचा पर्याय म्हणून स्वतःला सिद्ध केले आहे.
21 व्या शतकात, मानवी जीवनाच्या आणि क्रियाकलापांच्या सर्व क्षेत्रांमध्ये ओझोनचा वापर वाढत आहे आणि विकसित होत आहे, आणि म्हणूनच आम्ही त्याचे रूपांतर विदेशीपासून दैनंदिन कामासाठी परिचित साधनामध्ये पाहत आहोत. OZONE O3, ऑक्सिजनचे अलोट्रॉपिक स्वरूप.
ओझोन प्राप्त करणे आणि भौतिक गुणधर्म.
इलेक्ट्रोस्टॅटिक मशीनवर प्रयोग सुरू केल्यावर शास्त्रज्ञांना अज्ञात वायूच्या अस्तित्वाची जाणीव झाली. हे 17 व्या शतकात घडले. परंतु त्यांनी पुढील शतकाच्या शेवटीच नवीन वायूचा अभ्यास करण्यास सुरुवात केली. 1785 मध्ये, डच भौतिकशास्त्रज्ञ मार्टिन व्हॅन मारुम यांनी ऑक्सिजनमधून इलेक्ट्रिकल स्पार्क्स पास करून ओझोन तयार केले. ओझोन नाव फक्त 1840 मध्ये दिसले; त्याचा शोध स्विस रसायनशास्त्रज्ञ ख्रिश्चन शॉनबीन याने लावला होता, तो ग्रीक ओझोनपासून घेतला होता, वास घेत होता. या वायूची रासायनिक रचना ऑक्सिजनपेक्षा वेगळी नव्हती, परंतु अधिक आक्रमक होती. म्हणून, त्याने तपकिरी आयोडीनच्या मुक्ततेसह रंगहीन पोटॅशियम आयोडाइडचे त्वरित ऑक्सीकरण केले; शेनबीनने पोटॅशियम आयोडाइड आणि स्टार्चच्या द्रावणाने गर्भित केलेल्या कागदाच्या निळसरपणानुसार ओझोन निर्धारित करण्यासाठी ही प्रतिक्रिया वापरली. अगदी पारा आणि चांदी, जे खोलीच्या तपमानावर निष्क्रिय असतात, ओझोनच्या उपस्थितीत ऑक्सिडायझेशन करतात.
असे दिसून आले की ऑक्सिजन सारख्या ओझोन रेणूंमध्ये केवळ ऑक्सिजनचे अणू असतात, केवळ दोन नव्हे तर तीन असतात. ऑक्सिजन O2 आणि ओझोन O3 हे एका रासायनिक घटकाद्वारे दोन वायू (सामान्य स्थितीत) साध्या पदार्थांच्या निर्मितीचे एकमेव उदाहरण आहे. O3 रेणूमध्ये, अणू एका कोनात असतात, म्हणून हे रेणू ध्रुवीय असतात. ओझोन मुक्त ऑक्सिजन अणूंच्या O2 रेणूंना "चिकटून" परिणामी तयार होतो, जे विद्युत स्त्राव, अल्ट्राव्हायोलेट किरण, गॅमा किरण, वेगवान इलेक्ट्रॉन आणि इतर उच्च-ऊर्जा कणांच्या कृती अंतर्गत ऑक्सिजन रेणूंपासून तयार होतात. ओझोन नेहमी कार्यरत इलेक्ट्रिक मशीन्सजवळ वास घेतो, ज्यामध्ये ब्रश "स्पार्कल" असतात, जिवाणूनाशक पारा-क्वार्ट्ज दिवे जे अल्ट्राव्हायोलेट किरणोत्सर्ग उत्सर्जित करतात. काही रासायनिक अभिक्रियांदरम्यान ऑक्सिजनचे अणू देखील सोडले जातात. अम्लीकृत पाण्याच्या इलेक्ट्रोलिसिसच्या वेळी, हवेतील ओल्या पांढऱ्या फॉस्फरसच्या संथ ऑक्सिडेशनच्या वेळी, पाण्यावरील फ्लोरिनच्या कृतीमुळे (KMnO4, K2Cr2O7, इ.) उच्च ऑक्सिजन सामग्री असलेल्या संयुगांच्या विघटनादरम्यान ओझोन कमी प्रमाणात तयार होतो. किंवा एकाग्र सल्फ्यूरिक ऍसिडच्या बेरियम पेरोक्साइडवर. ऑक्सिजनचे अणू नेहमी ज्वालामध्ये असतात, म्हणून जर तुम्ही संकुचित हवेचा प्रवाह ऑक्सिजन बर्नरच्या ज्वालावर निर्देशित केला तर ओझोनचा वैशिष्ट्यपूर्ण वास हवेत आढळेल.
3O2 → 2O3 ही प्रतिक्रिया अत्यंत एंडोथर्मिक आहे: 1 मोल ओझोन तयार करण्यासाठी 142 kJ खर्च करणे आवश्यक आहे. उलट प्रतिक्रिया उर्जेच्या प्रकाशनासह पुढे जाते आणि अगदी सहजतेने चालते. त्यानुसार, ओझोन अस्थिर आहे. अशुद्धतेच्या अनुपस्थितीत, वायू ओझोन 70 डिग्री सेल्सिअस तपमानावर हळूहळू आणि 100 डिग्री सेल्सिअसच्या वर लवकर विघटित होतो. उत्प्रेरकांच्या उपस्थितीत ओझोनच्या विघटनाचा दर लक्षणीय वाढतो. ते वायू असू शकतात (उदाहरणार्थ, नायट्रिक ऑक्साईड, क्लोरीन), आणि बरेच घन पदार्थ (अगदी पात्रांच्या भिंती). म्हणून, शुद्ध ओझोन मिळवणे कठीण आहे आणि स्फोटाच्या शक्यतेमुळे त्याच्यासह कार्य करणे धोकादायक आहे.
हे आश्चर्यकारक नाही की ओझोनच्या शोधानंतर अनेक दशके, त्याचे मूलभूत भौतिक स्थिरांक देखील अज्ञात होते: बर्याच काळापासून कोणीही शुद्ध ओझोन मिळवू शकला नाही. डी.आय. मेंडेलीव्हने त्याच्या रसायनशास्त्राच्या मूलभूत पुस्तकात लिहिल्याप्रमाणे, "वायू ओझोन तयार करण्याच्या सर्व पद्धतींसह, ऑक्सिजनमधील त्याची सामग्री नेहमीच क्षुल्लक असते, सामान्यत: काही दशांश टक्के असते, क्वचितच 2% असते आणि केवळ अगदी कमी तापमानात ते पोहोचते. 20%.” केवळ 1880 मध्ये, जे. गोटफेल आणि पी. चप्पुई या फ्रेंच शास्त्रज्ञांनी शुद्ध ऑक्सिजनपासून उणे 23 डिग्री सेल्सिअस तापमानात ओझोन मिळवला. जाड थरात ओझोनला सुंदर निळा रंग असल्याचे निष्पन्न झाले. जेव्हा थंड केलेला ओझोनेटेड ऑक्सिजन हळूहळू संकुचित केला गेला तेव्हा वायू गडद निळा झाला आणि दाब वेगाने सोडल्यानंतर तापमान आणखी कमी झाले आणि गडद जांभळ्या द्रव ओझोनचे थेंब तयार झाले. जर गॅस त्वरीत थंड किंवा संकुचित झाला नाही, तर ओझोन त्वरित, पिवळ्या फ्लॅशसह, ऑक्सिजनमध्ये बदलला.
नंतर, ओझोनच्या संश्लेषणासाठी एक सोयीस्कर पद्धत विकसित केली गेली. जर पेर्क्लोरिक, फॉस्फोरिक किंवा सल्फ्यूरिक ऍसिडच्या एकाग्र द्रावणावर प्लॅटिनम किंवा लीड (IV) ऑक्साईडच्या थंड केलेल्या एनोडसह इलेक्ट्रोलिसिस केले जाते, तर एनोडमध्ये सोडलेल्या वायूमध्ये 50% पर्यंत ओझोन असेल. ओझोनचे भौतिक स्थिरांक देखील परिष्कृत केले गेले. ते -112 ° से (ऑक्सिजन - -183 ° से) तापमानात - ऑक्सिजनपेक्षा खूपच हलके बनते. -192.7 ° से, ओझोन घनरूप होतो. घन ओझोन निळ्या-काळ्या रंगाचा असतो.
ओझोनचे प्रयोग धोकादायक आहेत. हवेतील एकाग्रता 9% पेक्षा जास्त असल्यास वायू ओझोन विस्फोट करण्यास सक्षम आहे. द्रव आणि घन ओझोन अधिक सहजपणे स्फोट होतात, विशेषत: ऑक्सिडायझिंग पदार्थांच्या संपर्कात असताना. ओझोन कमी तापमानात फ्लोरिनेटेड हायड्रोकार्बन्स (फ्रॉन्स) मध्ये द्रावणाच्या स्वरूपात साठवले जाऊ शकते. हे द्रावण निळ्या रंगाचे असतात.
ओझोनचे रासायनिक गुणधर्म.
ओझोन एक अत्यंत उच्च प्रतिक्रिया द्वारे दर्शविले जाते. ओझोन हे सर्वात मजबूत ऑक्सिडायझिंग घटकांपैकी एक आहे आणि या संदर्भात केवळ फ्लोरिन आणि ऑक्सिजन फ्लोराईड OF2 पेक्षा निकृष्ट आहे. ऑक्सिडायझिंग एजंट म्हणून ओझोनचे सक्रिय तत्त्व म्हणजे अणू ऑक्सिजन, जो ओझोन रेणूच्या क्षय दरम्यान तयार होतो. म्हणून, ऑक्सिडायझिंग एजंट म्हणून काम करताना, ओझोन रेणू, एक नियम म्हणून, फक्त एक ऑक्सिजन अणू “वापरतो”, तर इतर दोन मुक्त ऑक्सिजनच्या स्वरूपात सोडले जातात, उदाहरणार्थ, 2KI + O3 + H2O → I2 + 2KOH + O2. इतर अनेक संयुगे त्याच प्रकारे ऑक्सिडाइझ केली जातात. तथापि, काही अपवाद आहेत जेव्हा ओझोन रेणू ऑक्सिडेशनसाठी ऑक्सिजनचे तीनही अणू वापरतो, उदाहरणार्थ, 3SO2 + O3 → 3SO3; Na2S + O3 → Na2SO3.
ओझोन आणि ऑक्सिजनमधील एक अतिशय महत्त्वाचा फरक म्हणजे ओझोन खोलीच्या तपमानावर आधीच ऑक्सिडायझिंग गुणधर्म प्रदर्शित करतो. उदाहरणार्थ, PbS आणि Pb(OH)2 सामान्य परिस्थितीत ऑक्सिजनवर प्रतिक्रिया देत नाहीत, तर ओझोनच्या उपस्थितीत सल्फाइडचे PbSO4 मध्ये आणि हायड्रॉक्साइडचे PbO2 मध्ये रूपांतर होते. जर अमोनियाचे एकाग्र द्रावण ओझोन असलेल्या भांड्यात ओतले तर पांढरा धूर दिसून येईल - या ओझोनमध्ये अमोनियम नायट्रेट NH4NO2 तयार करण्यासाठी अमोनियाचे ऑक्सिडीकरण केले जाते. AgO आणि Ag2O3 च्या निर्मितीसह चांदीच्या वस्तू "काळ्या" करण्याची क्षमता हे ओझोनचे वैशिष्ट्य आहे.
एक इलेक्ट्रॉन जोडल्याने आणि नकारात्मक आयन O3- मध्ये बदलल्यास, ओझोन रेणू अधिक स्थिर होतो. "ओझोनेट ग्लायकोकॉलेट" किंवा ओझोनाइड्स ज्यामध्ये असे आयन आहेत ते बर्याच काळापासून ज्ञात आहेत - ते लिथियम वगळता सर्व अल्कली धातूंनी तयार होतात आणि ओझोनाइड्सची स्थिरता सोडियमपासून सीझियमपर्यंत वाढते. क्षारीय पृथ्वी धातूंचे काही ओझोनाइड देखील ओळखले जातात, उदाहरणार्थ Ca(O3)2. जर वायू ओझोनचा प्रवाह घन कोरड्या अल्कलीच्या पृष्ठभागावर निर्देशित केला असेल तर ओझोनाइड्स असलेले नारिंगी-लाल कवच तयार होते, उदाहरणार्थ, 4KOH + 4O3 → 4KO3 + O2 + 2H2O. त्याच वेळी, घन अल्कली प्रभावीपणे पाण्याला बांधते, जे ओझोनाइडला त्वरित हायड्रोलिसिसपासून प्रतिबंधित करते. तथापि, जास्त पाण्यामुळे, ओझोनाइड्स वेगाने विघटित होतात: 4KO3 + 2H2O → 4KOH + 5O2. स्टोरेज दरम्यान विघटन देखील होते: 2KO3 → 2KO2 + O2. ओझोनाइड्स द्रव अमोनियामध्ये अत्यंत विद्रव्य असतात, ज्यामुळे त्यांना त्यांच्या शुद्ध स्वरूपात वेगळे करणे आणि त्यांच्या गुणधर्मांचा अभ्यास करणे शक्य झाले.
सेंद्रिय पदार्थ ज्या ओझोनच्या संपर्कात येतात, ते सहसा नष्ट करतात. तर, ओझोन, क्लोरीनच्या विपरीत, बेंझिन रिंग विभाजित करण्यास सक्षम आहे. ओझोनसह काम करताना, आपण रबर ट्यूब आणि होसेस वापरू शकत नाही - ते त्वरित "गळती" होतील. ओझोन मोठ्या प्रमाणात ऊर्जा सोडल्यानंतर सेंद्रिय संयुगेसह प्रतिक्रिया देते. उदाहरणार्थ, इथर, अल्कोहोल, टर्पेन्टाइन, मिथेन आणि इतर अनेक पदार्थांनी ओले केलेले कापसाचे लोकर ओझोनीकृत हवेच्या संपर्कात असताना उत्स्फूर्तपणे प्रज्वलित होते आणि इथिलीनमध्ये ओझोन मिसळल्याने जोरदार स्फोट होतो.
ओझोनचा वापर.
ओझोन नेहमी सेंद्रिय पदार्थ "बर्न" करत नाही; बर्याच प्रकरणांमध्ये अत्यंत पातळ ओझोनसह विशिष्ट प्रतिक्रिया करणे शक्य आहे. उदाहरणार्थ, ओलेइक अॅसिडचे ओझोनेशन (ते वनस्पती तेलांमध्ये मोठ्या प्रमाणात आढळते) अॅझेलेइक अॅसिड HOOC(CH2)7COOH तयार करते, ज्याचा वापर प्लास्टिकसाठी उच्च-गुणवत्तेचे स्नेहन तेल, कृत्रिम तंतू आणि प्लास्टिसायझर्स तयार करण्यासाठी केला जातो. त्याचप्रमाणे, ऍडिपिक ऍसिड प्राप्त होते, जे नायलॉनच्या संश्लेषणात वापरले जाते. 1855 मध्ये, शॉनबीनने ओझोनसह C=C दुहेरी बंध असलेल्या असंतृप्त संयुगांची प्रतिक्रिया शोधून काढली, परंतु 1925 पर्यंत जर्मन रसायनशास्त्रज्ञ एच. स्टॉडिंगर यांनी या अभिक्रियाची यंत्रणा स्थापन केली. ओझोन रेणू ओझोनाइडच्या निर्मितीसह दुहेरी बाँडमध्ये सामील होतो - यावेळी सेंद्रिय, आणि ऑक्सिजन अणू C \u003d C बंधांपैकी एकाची जागा घेतो आणि -O-O- गट दुसऱ्याची जागा घेतो. जरी काही सेंद्रिय ओझोनाइड्स शुद्ध स्वरूपात वेगळे केले गेले आहेत (उदाहरणार्थ, इथिलीन ओझोनाइड), ही प्रतिक्रिया सामान्यतः सौम्य द्रावणात केली जाते, कारण मुक्त अवस्थेतील ओझोनाइड्स अतिशय अस्थिर स्फोटक असतात. असंतृप्त यौगिकांच्या ओझोनेशन प्रतिक्रिया सेंद्रिय रसायनशास्त्रज्ञांमध्ये खूप आदर आहे; शालेय ऑलिम्पियाडमध्येही या प्रतिक्रियेतील समस्या अनेकदा दिल्या जातात. वस्तुस्थिती अशी आहे की जेव्हा ओझोनाइड पाण्याद्वारे विघटित होते, तेव्हा अॅल्डिहाइड किंवा केटोनचे दोन रेणू तयार होतात, जे मूळ असंतृप्त संयुगाची रचना ओळखणे आणि पुढे स्थापित करणे सोपे आहे. अशाप्रकारे, 20 व्या शतकाच्या सुरूवातीस, रसायनशास्त्रज्ञांनी C=C बंध असलेल्या नैसर्गिक यांसह अनेक महत्त्वाच्या सेंद्रिय संयुगांची रचना स्थापित केली.
ओझोन वापरण्याचे महत्त्वाचे क्षेत्र म्हणजे पिण्याच्या पाण्याचे निर्जंतुकीकरण. सहसा पाणी क्लोरिनेटेड असते. तथापि, क्लोरीनच्या प्रभावाखाली पाण्यातील काही अशुद्धता अतिशय अप्रिय गंधाने संयुगेमध्ये रूपांतरित होतात. म्हणून, ओझोनसह क्लोरीन पुनर्स्थित करण्याचा प्रस्ताव बर्याच काळापासून आहे. ओझोनेटेड पाणी परदेशी वास किंवा चव घेत नाही; जेव्हा अनेक सेंद्रिय संयुगे ओझोनसह पूर्णपणे ऑक्सिडाइझ होतात तेव्हा फक्त कार्बन डायऑक्साइड आणि पाणी तयार होते. ओझोन आणि कचरा पाण्याने शुद्ध करा. फिनोल्स, सायनाइड्स, सर्फॅक्टंट्स, सल्फाइट्स, क्लोरामाईन्स सारख्या प्रदूषकांच्या ओझोन ऑक्सिडेशनची उत्पादने रंग आणि गंध नसलेली निरुपद्रवी संयुगे आहेत. ऑक्सिजनच्या निर्मितीसह अतिरिक्त ओझोन त्वरीत विघटित होते. तथापि, क्लोरिनेशनपेक्षा पाण्याचे ओझोनेशन अधिक महाग आहे; याव्यतिरिक्त, ओझोनची वाहतूक करता येत नाही आणि साइटवर त्याचे उत्पादन करणे आवश्यक आहे.
वातावरणातील ओझोन.
पृथ्वीच्या वातावरणात जास्त ओझोन नाही - 4 अब्ज टन, म्हणजे. सरासरी फक्त 1 mg/m3. ओझोनची एकाग्रता पृथ्वीच्या पृष्ठभागापासून अंतरासह वाढते आणि 20-25 किमी उंचीवर, स्ट्रॅटोस्फियरमध्ये जास्तीत जास्त पोहोचते - हा "ओझोन स्तर" आहे. जर वातावरणातील सर्व ओझोन पृथ्वीच्या पृष्ठभागाजवळ सामान्य दाबाने गोळा केले गेले तर फक्त 2-3 मिमी जाडीचा थर मिळेल. आणि हवेतील ओझोनचे इतके कमी प्रमाण पृथ्वीवर जीवन प्रदान करते. ओझोन एक "संरक्षणात्मक स्क्रीन" तयार करते जी सूर्याच्या कठोर अल्ट्राव्हायोलेट किरणांना पृथ्वीच्या पृष्ठभागावर पोहोचू देत नाही, जे सर्व सजीवांसाठी हानिकारक आहेत.
अलिकडच्या दशकांमध्ये, तथाकथित "ओझोन छिद्र" - स्ट्रॅटोस्फेरिक ओझोनची लक्षणीय प्रमाणात कमी सामग्री असलेले क्षेत्र - उदयाकडे जास्त लक्ष दिले गेले आहे. अशा "गळती" ढालद्वारे, सूर्याचे कठीण अतिनील किरणे पृथ्वीच्या पृष्ठभागावर पोहोचतात. त्यामुळे शास्त्रज्ञ दीर्घकाळापासून वातावरणातील ओझोनचे निरीक्षण करत आहेत. 1930 मध्ये, इंग्लिश भूभौतिकशास्त्रज्ञ एस. चॅपमन यांनी स्ट्रॅटोस्फियरमध्ये ओझोनच्या स्थिर एकाग्रतेचे स्पष्टीकरण देण्यासाठी चार प्रतिक्रियांची योजना प्रस्तावित केली (या प्रतिक्रियांना चॅपमन चक्र म्हणतात, ज्यामध्ये एम म्हणजे अतिरिक्त ऊर्जा वाहून नेणारा कोणताही अणू किंवा रेणू):
O + O + M → O2 + M
O + O3 → 2O2
O3 → O2 + O.
या चक्राच्या पहिल्या आणि चौथ्या प्रतिक्रिया फोटोकेमिकल आहेत, त्या सौर किरणोत्सर्गाच्या प्रभावाखाली आहेत. ऑक्सिजन रेणूचे अणूंमध्ये विघटन करण्यासाठी, 242 nm पेक्षा कमी तरंगलांबीसह किरणोत्सर्ग आवश्यक आहे, तर 240-320 nm च्या प्रदेशात प्रकाश शोषला जातो तेव्हा ओझोनचा क्षय होतो (नंतरची प्रतिक्रिया आपल्याला कठोर अल्ट्राव्हायोलेटपासून संरक्षण करते, कारण ऑक्सिजन या वर्णक्रमीय प्रदेशात शोषून घेत नाही). उर्वरित दोन प्रतिक्रिया थर्मल आहेत, म्हणजे. प्रकाशाच्या क्रियेशिवाय जा. हे खूप महत्वाचे आहे की ओझोन गायब होण्यास कारणीभूत असलेल्या तिसर्या प्रतिक्रियामध्ये सक्रियता ऊर्जा असते; याचा अर्थ उत्प्रेरकांच्या क्रियेद्वारे अशा प्रतिक्रियेचा दर वाढविला जाऊ शकतो. जसे असे झाले की, ओझोनच्या क्षयसाठी मुख्य उत्प्रेरक नायट्रिक ऑक्साईड NO आहे. हे नायट्रोजन आणि ऑक्सिजनपासून वरच्या वातावरणात सर्वात गंभीर सौर किरणोत्सर्गाच्या प्रभावाखाली तयार होते. एकदा ओझोनोस्फियरमध्ये, ते O3 + NO → NO2 + O2, NO2 + O → NO + O2 या दोन प्रतिक्रियांच्या चक्रात प्रवेश करते, परिणामी वातावरणातील त्याची सामग्री बदलत नाही आणि स्थिर ओझोन एकाग्रता कमी होते. स्ट्रॅटोस्फियरमधील ओझोन सामग्री कमी करणारे इतर चक्र आहेत, उदाहरणार्थ, क्लोरीनच्या सहभागासह:
Cl + O3 → ClO + O2
ClO + O → Cl + O2.
ओझोन धूळ आणि वायूंमुळे देखील नष्ट होतो, जे ज्वालामुखीच्या उद्रेकादरम्यान मोठ्या प्रमाणात वातावरणात प्रवेश करतात. अलीकडे, असे सूचित केले गेले आहे की ओझोन पृथ्वीच्या कवचातून सोडलेल्या हायड्रोजनचा नाश करण्यासाठी देखील प्रभावी आहे. ओझोनची निर्मिती आणि क्षय या सर्व प्रतिक्रियांची संपूर्णता ही वस्तुस्थिती दर्शवते की स्ट्रॅटोस्फियरमध्ये ओझोन रेणूचे सरासरी आयुष्य सुमारे तीन तास असते.
असे मानले जाते की नैसर्गिक व्यतिरिक्त, ओझोन थरावर परिणाम करणारे कृत्रिम घटक देखील आहेत. एक सुप्रसिद्ध उदाहरण म्हणजे फ्रीॉन्स, जे क्लोरीन अणूंचे स्त्रोत आहेत. फ्रीॉन्स हे हायड्रोकार्बन्स आहेत ज्यामध्ये हायड्रोजन अणू फ्लोरिन आणि क्लोरीन अणूंनी बदलले आहेत. ते रेफ्रिजरेशनमध्ये आणि एरोसोल कॅन भरण्यासाठी वापरले जातात. सरतेशेवटी, फ्रीॉन हवेत प्रवेश करतात आणि हवेच्या प्रवाहासह हळूहळू उंच आणि उंच होतात, शेवटी ओझोन थरापर्यंत पोहोचतात. सौर किरणोत्सर्गाच्या क्रियेत विघटित होऊन, फ्रीॉन्स स्वतः उत्प्रेरकपणे ओझोनचे विघटन करण्यास सुरवात करतात. "ओझोन छिद्र" साठी फ्रीॉन्स किती प्रमाणात जबाबदार आहेत हे अद्याप निश्चितपणे माहित नाही आणि तरीही, त्यांचा वापर मर्यादित करण्यासाठी उपाययोजना केल्या गेल्या आहेत.
गणना दर्शविते की 60-70 वर्षांत स्ट्रॅटोस्फियरमधील ओझोन एकाग्रता 25% कमी होऊ शकते. आणि त्याच वेळी, पृष्ठभागाच्या थरात ओझोनची एकाग्रता - ट्रोपोस्फियरमध्ये वाढ होईल, जे देखील वाईट आहे, कारण ओझोन आणि हवेतील त्याच्या परिवर्तनाची उत्पादने विषारी आहेत. ट्रोपोस्फियरमधील ओझोनचा मुख्य स्त्रोत म्हणजे स्ट्रॅटोस्फेरिक ओझोनचे हवेच्या वस्तुमानासह खालच्या स्तरांवर हस्तांतरण. दरवर्षी अंदाजे 1.6 अब्ज टन ओझोनच्या जमिनीच्या थरात प्रवेश करतात. वातावरणाच्या खालच्या भागात ओझोन रेणूचे आयुष्य जास्त असते - 100 दिवसांपेक्षा जास्त, कारण पृष्ठभागाच्या थरामध्ये ओझोन नष्ट करणाऱ्या अल्ट्राव्हायोलेट सौर किरणोत्सर्गाची तीव्रता कमी असते. सहसा, ट्रोपोस्फियरमध्ये ओझोन फारच कमी असते: स्वच्छ ताजी हवेमध्ये, त्याची एकाग्रता सरासरी फक्त 0.016 μg / l असते. हवेतील ओझोनचे प्रमाण केवळ उंचीवरच नाही तर भूप्रदेशावरही अवलंबून असते. अशा प्रकारे, जमिनीपेक्षा महासागरांवर नेहमीच जास्त ओझोन असतो, कारण तेथे ओझोनचा क्षय अधिक हळूहळू होतो. सोचीमधील मोजमापांनी दर्शविले की समुद्रकिनाऱ्याजवळील हवेमध्ये किनार्यापासून 2 किमी अंतरावरील जंगलापेक्षा 20% जास्त ओझोन आहे.
आधुनिक मानव त्यांच्या पूर्वजांपेक्षा जास्त ओझोन श्वास घेतात. हवेतील मिथेन आणि नायट्रोजन ऑक्साईडचे प्रमाण वाढणे हे त्याचे प्रमुख कारण आहे. अशा प्रकारे, 19 व्या शतकाच्या मध्यापासून, जेव्हा नैसर्गिक वायूचा वापर सुरू झाला तेव्हापासून वातावरणातील मिथेनचे प्रमाण सतत वाढत आहे. नायट्रोजन ऑक्साईडसह प्रदूषित वातावरणात, मिथेन ऑक्सिजन आणि पाण्याची वाफ असलेल्या परिवर्तनांच्या जटिल साखळीत प्रवेश करते, ज्याचा परिणाम CH4 + 4O2 → HCHO + H2O + 2O3 या समीकरणाद्वारे व्यक्त केला जाऊ शकतो. इतर हायड्रोकार्बन्स देखील मिथेन म्हणून कार्य करू शकतात, उदाहरणार्थ, गॅसोलीनच्या अपूर्ण दहन दरम्यान कारच्या एक्झॉस्ट गॅसमध्ये समाविष्ट असलेले. परिणामी, गेल्या दशकांमध्ये मोठ्या शहरांच्या हवेत ओझोनचे प्रमाण दहापट वाढले आहे.
असे नेहमीच मानले जाते की वादळाच्या वेळी, हवेतील ओझोनची एकाग्रता नाटकीयरित्या वाढते, कारण वीज ऑक्सिजनचे ओझोनमध्ये रूपांतर करण्यास योगदान देते. खरं तर, वाढ नगण्य आहे आणि ती वादळाच्या वेळी होत नाही, परंतु त्याच्या काही तास आधी होते. गडगडाटी वादळादरम्यान आणि त्यानंतर काही तासांपर्यंत, ओझोनची एकाग्रता कमी होते. हे या वस्तुस्थितीद्वारे स्पष्ट केले आहे की गडगडाटीपूर्वी हवेच्या वस्तुमानांचे एक मजबूत अनुलंब मिश्रण होते, ज्यामुळे ओझोनची अतिरिक्त मात्रा वरच्या थरांमधून येते. याव्यतिरिक्त, गडगडाटी वादळापूर्वी, विद्युत क्षेत्राची ताकद वाढते आणि विविध वस्तूंच्या बिंदूंवर, उदाहरणार्थ, शाखांच्या टिपांवर कोरोना डिस्चार्ज तयार करण्यासाठी परिस्थिती निर्माण केली जाते. हे ओझोनच्या निर्मितीमध्ये देखील योगदान देते. आणि मग, मेघगर्जनेच्या विकासासह, त्याखाली शक्तिशाली चढत्या वायु प्रवाह उद्भवतात, ज्यामुळे ओझोनचे प्रमाण थेट ढगाखाली कमी होते.
एक मनोरंजक प्रश्न शंकूच्या आकाराचे जंगलातील हवेतील ओझोन सामग्रीबद्दल आहे. उदाहरणार्थ, जी. रेमीच्या अजैविक रसायनशास्त्राच्या कोर्समध्ये, कोणीही वाचू शकतो की "शंकूच्या आकाराच्या जंगलांची ओझोनाइज्ड हवा" ही एक काल्पनिक कथा आहे. असे आहे का? कोणतीही वनस्पती अर्थातच ओझोन उत्सर्जित करत नाही. परंतु वनस्पती, विशेषत: कोनिफर, हवेत भरपूर अस्थिर सेंद्रिय संयुगे उत्सर्जित करतात, ज्यात टेरपीन वर्गाच्या असंतृप्त हायड्रोकार्बन्सचा समावेश आहे (त्यापैकी बरेच टर्पेन्टाइनमध्ये आहेत). तर, उष्णतेच्या दिवशी, पाइनचे झाड सुयांच्या कोरड्या वजनाच्या प्रत्येक ग्रॅमसाठी प्रति तास 16 मायक्रोग्राम टर्पेन सोडते. टर्पेनस केवळ शंकूच्या आकाराचेच नव्हे तर काही पर्णपाती झाडांद्वारे देखील ओळखले जातात, त्यापैकी चिनार आणि निलगिरी आहेत. आणि काही उष्णकटिबंधीय झाडे प्रति तास 1 ग्रॅम कोरड्या पानांच्या वस्तुमानात 45 मायक्रोग्राम टर्पेन सोडू शकतात. परिणामी, एक हेक्टर शंकूच्या आकाराचे जंगल दररोज 4 किलोपर्यंत सेंद्रिय पदार्थ आणि सुमारे 2 किलो पर्णपाती जंगल सोडू शकते. पृथ्वीचे वनक्षेत्र लाखो हेक्टर आहे आणि त्या सर्वांमधून दरवर्षी हजारो टन विविध हायड्रोकार्बन्स टर्पेनेससह सोडले जातात. आणि हायड्रोकार्बन्स, जसे मिथेनच्या उदाहरणात दर्शविल्याप्रमाणे, सौर किरणोत्सर्गाच्या प्रभावाखाली आणि इतर अशुद्धतेच्या उपस्थितीत ओझोनच्या निर्मितीस हातभार लावतात. प्रयोगांनी दर्शविले आहे की, योग्य परिस्थितीत, टेरपेन्स खरोखरच ओझोनच्या निर्मितीसह वातावरणातील प्रकाशरासायनिक अभिक्रियांच्या चक्रात सक्रियपणे गुंतलेले असतात. त्यामुळे शंकूच्या आकाराच्या जंगलातील ओझोन हा मुळीच शोध नसून एक प्रायोगिक वस्तुस्थिती आहे.
ओझोन आणि आरोग्य.
वादळानंतर फेरफटका मारण्यात किती आनंद होतो! हवा स्वच्छ आणि ताजी आहे, तिचे स्फूर्तिदायक जेट कोणत्याही प्रयत्नाशिवाय फुफ्फुसात वाहत असल्याचे दिसते. "त्याला ओझोनसारखा वास येतो," ते सहसा अशा प्रकरणांमध्ये म्हणतात. "आरोग्यासाठी खूप चांगले." असे आहे का?
एकेकाळी ओझोन हे आरोग्यासाठी नक्कीच फायदेशीर मानले जात असे. परंतु जर त्याची एकाग्रता एका विशिष्ट थ्रेशोल्डपेक्षा जास्त असेल तर, यामुळे बरेच अप्रिय परिणाम होऊ शकतात. एकाग्रता आणि इनहेलेशनच्या वेळेनुसार, ओझोनमुळे फुफ्फुसांमध्ये बदल होतो, डोळे आणि नाकातील श्लेष्मल त्वचेची जळजळ, डोकेदुखी, चक्कर येणे, रक्तदाब कमी होतो; ओझोन श्वसनमार्गाच्या जिवाणू संसर्गास शरीराचा प्रतिकार कमी करते. हवेतील त्याची जास्तीत जास्त परवानगीयोग्य एकाग्रता फक्त 0.1 µg/l आहे, याचा अर्थ ओझोन क्लोरीनपेक्षा जास्त धोकादायक आहे! आपण फक्त 0.4 μg / l च्या ओझोन एकाग्रतेसह अनेक तास घरात घालवल्यास, छातीत दुखणे, खोकला, निद्रानाश दिसू शकतो, दृश्य तीक्ष्णता कमी होते. जर तुम्ही 2 μg/l पेक्षा जास्त एकाग्रतेत ओझोनमध्ये दीर्घकाळ श्वास घेत असाल, तर त्याचे परिणाम अधिक गंभीर असू शकतात - मूर्खपणापर्यंत आणि ह्रदयाच्या क्रियाकलापात घट. 8-9 µg/l च्या ओझोन सामग्रीसह, फुफ्फुसाचा सूज काही तासांनंतर उद्भवतो, जो मृत्यूने भरलेला असतो. परंतु पदार्थाच्या अशा नगण्य प्रमाणांचे पारंपारिक रासायनिक पद्धतींनी विश्लेषण करणे सहसा कठीण असते. सुदैवाने, एखाद्या व्यक्तीला ओझोनची उपस्थिती आधीच खूप कमी प्रमाणात जाणवते - सुमारे 1 μg / l, ज्यावर स्टार्च आयोडीन पेपर निळा होणार नाही. काही लोकांसाठी, ओझोनचा वास लहान प्रमाणात क्लोरीनच्या वासासारखा असतो, इतरांना - सल्फर डायऑक्साइड, इतरांना - लसूण.
हे केवळ ओझोनच विषारी नाही. हवेतील त्याच्या सहभागाने, उदाहरणार्थ, पेरोक्सायसेटिल नायट्रेट (PAN) CH3-CO-OONO2 तयार होतो - एक पदार्थ ज्यामध्ये तीव्र चिडचिड आहे, ज्यामध्ये अश्रू, प्रभाव ज्यामुळे श्वास घेण्यास त्रास होतो आणि जास्त प्रमाणात हृदय पक्षाघात होतो. PAN हा प्रदूषित हवेत उन्हाळ्यात तयार होणाऱ्या तथाकथित फोटोकेमिकल स्मॉगच्या घटकांपैकी एक घटक आहे (हा शब्द इंग्रजी स्मोक - स्मोक आणि फॉग - फॉग वरून आला आहे). स्मॉगमध्ये ओझोनची एकाग्रता 2 μg/l पर्यंत पोहोचू शकते, जी जास्तीत जास्त स्वीकार्य पेक्षा 20 पट जास्त आहे. हे देखील लक्षात घेतले पाहिजे की हवेतील ओझोन आणि नायट्रोजन ऑक्साईड्सचा एकत्रित प्रभाव प्रत्येक पदार्थापेक्षा दहापट अधिक मजबूत असतो. आश्चर्याची गोष्ट नाही की, मोठ्या शहरांमध्ये अशा धुक्याचे परिणाम आपत्तीजनक असू शकतात, विशेषत: जर शहराच्या वरची हवा "मसुदे" द्वारे उडविली गेली नाही आणि एक स्थिर झोन फॉर्म झाला. तर, लंडनमध्ये 1952 मध्ये, धुक्यामुळे काही दिवसांत 4,000 हून अधिक लोक मरण पावले. 1963 मध्ये न्यूयॉर्कमध्ये धुक्यामुळे 350 लोकांचा मृत्यू झाला होता. तत्सम कथा टोकियो आणि इतर मोठ्या शहरांमध्ये होत्या. केवळ लोकांनाच वातावरणातील ओझोनचा त्रास होत नाही. उदाहरणार्थ, अमेरिकन संशोधकांनी दर्शविले आहे की हवेत ओझोनची उच्च सामग्री असलेल्या भागात, कार टायर आणि इतर रबर उत्पादनांचे सेवा आयुष्य लक्षणीयरीत्या कमी होते.
जमिनीच्या थरातील ओझोनचे प्रमाण कसे कमी करावे? वातावरणातील मिथेन उत्सर्जन कमी करणे हे फारसे वास्तववादी नाही. आणखी एक मार्ग शिल्लक आहे - नायट्रोजन ऑक्साईडचे उत्सर्जन कमी करण्यासाठी, ज्याशिवाय ओझोनकडे नेणाऱ्या प्रतिक्रियांचे चक्र जाऊ शकत नाही. हा मार्ग देखील सोपा नाही, कारण नायट्रोजन ऑक्साईड केवळ कारद्वारेच नाही तर (प्रामुख्याने) थर्मल पॉवर प्लांटद्वारे देखील उत्सर्जित केले जातात.
ओझोनचे स्त्रोत केवळ रस्त्यावरच नाहीत. हे क्ष-किरण खोल्यांमध्ये, फिजिओथेरपी खोल्यांमध्ये (त्याचा स्त्रोत पारा-क्वार्ट्ज दिवे आहे), कॉपियर्स (कॉपीअर्स), लेसर प्रिंटरच्या ऑपरेशन दरम्यान तयार होतो (येथे त्याच्या निर्मितीचे कारण उच्च-व्होल्टेज डिस्चार्ज आहे). पेरीहाइड्रोल, आर्गॉन आर्क वेल्डिंगच्या उत्पादनासाठी ओझोन एक अपरिहार्य साथीदार आहे. ओझोनचे हानिकारक प्रभाव कमी करण्यासाठी, अतिनील दिवे, खोलीचे चांगले वेंटिलेशनसह हुड सुसज्ज करणे आवश्यक आहे.
आणि तरीही, ओझोन, अर्थातच, आरोग्यासाठी हानिकारक मानणे क्वचितच योग्य आहे. हे सर्व त्याच्या एकाग्रतेवर अवलंबून असते. अभ्यासाने दर्शविले आहे की ताजी हवा अंधारात खूप कमकुवतपणे चमकते; ग्लोचे कारण ओझोनचा समावेश असलेली ऑक्सिडेशन प्रतिक्रिया आहे. फ्लास्कमध्ये पाणी हलवताना देखील चमक दिसून आली, ज्यामध्ये ओझोनीकृत ऑक्सिजन प्राथमिकपणे भरला गेला. ही चमक नेहमी हवा किंवा पाण्यात कमी प्रमाणात सेंद्रिय अशुद्धतेच्या उपस्थितीशी संबंधित असते. श्वास सोडलेल्या व्यक्तीमध्ये ताजी हवा मिसळताना, चमकाची तीव्रता दहापट वाढली! आणि हे आश्चर्यकारक नाही: इथिलीन, बेंझिन, एसीटाल्डिहाइड, फॉर्मल्डिहाइड, एसीटोन आणि फॉर्मिक ऍसिडची सूक्ष्म अशुद्धता श्वास सोडलेल्या हवेमध्ये आढळली. ते ओझोनद्वारे "हायलाइट" केले जातात. त्याच वेळी, "शिळा", म्हणजे. ओझोन पूर्णपणे विरहित, जरी अतिशय स्वच्छ, हवा चमक आणत नाही आणि एखाद्या व्यक्तीला ती "शिळी" वाटते. अशा हवेची तुलना डिस्टिल्ड वॉटरशी केली जाऊ शकते: ते अतिशय शुद्ध आहे, त्यात व्यावहारिकदृष्ट्या कोणतीही अशुद्धता नाही आणि ते पिणे हानिकारक आहे. तर हवेत ओझोनची पूर्ण अनुपस्थिती, वरवर पाहता, मानवांसाठी देखील प्रतिकूल आहे, कारण यामुळे त्यातील सूक्ष्मजीवांची सामग्री वाढते, हानिकारक पदार्थ आणि अप्रिय गंध जमा होतात, ज्यामुळे ओझोन नष्ट होतो. अशा प्रकारे, परिसराच्या नियमित आणि दीर्घकालीन वेंटिलेशनची आवश्यकता स्पष्ट होते, जरी त्यामध्ये लोक नसले तरीही: तथापि, खोलीत प्रवेश केलेला ओझोन बराच काळ त्यात रेंगाळत नाही - ते अंशतः विघटित होते. , आणि मोठ्या प्रमाणावर भिंती आणि इतर पृष्ठभागांवर स्थिर (शोषून घेते). खोलीत किती ओझोन असावे हे सांगणे कठीण आहे. तथापि, कमीतकमी एकाग्रतेमध्ये, ओझोन कदाचित आवश्यक आणि उपयुक्त आहे.
अशा प्रकारे, ओझोन एक टाइम बॉम्ब आहे. जर ते योग्यरित्या वापरले गेले तर ते मानवतेची सेवा करेल, परंतु इतर कारणांसाठी त्याचा वापर होताच, यामुळे त्वरित जागतिक आपत्ती होईल आणि पृथ्वी मंगळासारख्या ग्रहात बदलेल.
"ओझोन थर" हा वाक्यांश 70 च्या दशकात प्रसिद्ध झाला. गेल्या शतकात, लांब धार वर सेट केले आहे. त्याच वेळी, या संकल्पनेचा अर्थ काय आहे आणि ओझोन थराचा नाश का धोकादायक आहे हे काही लोकांना खरोखरच समजते. ओझोन रेणूची रचना हे अनेकांसाठी एक मोठे रहस्य आहे आणि तरीही ते थेट ओझोन थराच्या समस्यांशी संबंधित आहे. ओझोन, त्याची रचना आणि औद्योगिक उपयोग याविषयी अधिक जाणून घेऊ या.
ओझोन म्हणजे काय
ओझोन, किंवा, ज्याला सक्रिय ऑक्सिजन देखील म्हटले जाते, एक तीव्र धातूचा गंध असलेला आकाशी वायू आहे.
हा पदार्थ एकत्रीकरणाच्या तीनही अवस्थांमध्ये अस्तित्वात असू शकतो: वायू, घन आणि द्रव.
त्याच वेळी, ओझोन केवळ वायूच्या स्वरूपात निसर्गात उद्भवते, तथाकथित ओझोन थर तयार करते. त्याच्या निळसर रंगामुळेच आकाश निळे दिसते.
ओझोन रेणू कसा दिसतो?
ऑक्सिजनशी साम्य असल्यामुळे ओझोनला त्याचे टोपणनाव "सक्रिय ऑक्सिजन" मिळाले. तर या पदार्थांमधील मुख्य सक्रिय रासायनिक घटक ऑक्सिजन (O) आहे. तथापि, जर ऑक्सिजनच्या रेणूमध्ये त्याचे 2 अणू असतील, तर रेणू - O 3) मध्ये या घटकाचे 3 अणू असतात.
या संरचनेमुळे, ओझोनचे गुणधर्म ऑक्सिजनसारखेच आहेत, परंतु अधिक स्पष्ट आहेत. विशेषतः, O 2 प्रमाणे O 3 सर्वात मजबूत ऑक्सिडायझिंग एजंट आहे.
या "संबंधित" पदार्थांमधील सर्वात महत्त्वाचा फरक, जो प्रत्येकासाठी लक्षात ठेवणे आवश्यक आहे, खालीलप्रमाणे आहे: ओझोन श्वास घेता येत नाही, ते विषारी आहे आणि जर श्वास घेतल्यास, फुफ्फुसांना नुकसान होऊ शकते किंवा एखाद्या व्यक्तीचा मृत्यू देखील होऊ शकतो. त्याच वेळी, O 3 विषारी अशुद्धतेपासून हवा स्वच्छ करण्यासाठी योग्य आहे. तसे, यामुळेच पावसानंतर श्वास घेणे सोपे होते: ओझोन हवेतील हानिकारक पदार्थांचे ऑक्सिडाइझ करते आणि ते शुद्ध होते.
ओझोन रेणूचे मॉडेल (3 ऑक्सिजन अणू असलेले) हे थोडेसे कोनाच्या प्रतिमेसारखे दिसते आणि त्याचा आकार 117° आहे. या रेणूमध्ये कोणतेही जोडलेले इलेक्ट्रॉन नाहीत आणि म्हणून ते डायमॅग्नेटिक आहे. याव्यतिरिक्त, त्यात ध्रुवीयपणा आहे, जरी त्यात एका घटकाचे अणू असतात.

दिलेल्या रेणूचे दोन अणू एकमेकांशी घट्टपणे जोडलेले असतात. परंतु तिसर्याशी कनेक्शन कमी विश्वसनीय आहे. या कारणास्तव, ओझोन रेणू (मॉडेलचा फोटो खाली पाहिला जाऊ शकतो) अतिशय नाजूक आहे आणि तयार झाल्यानंतर लगेचच तो तुटतो. नियमानुसार, O 3 च्या विघटनाच्या कोणत्याही प्रतिक्रियेत, ऑक्सिजन सोडला जातो.
ओझोनच्या अस्थिरतेमुळे, इतर पदार्थांप्रमाणे त्याची कापणी, साठवण किंवा वाहतूक करता येत नाही. या कारणास्तव, त्याचे उत्पादन इतर पदार्थांपेक्षा अधिक महाग आहे.
त्याच वेळी, O 3 रेणूंची उच्च क्रिया या पदार्थाला सर्वात मजबूत ऑक्सिडायझिंग एजंट, ऑक्सिजनपेक्षा अधिक शक्तिशाली आणि क्लोरीनपेक्षा अधिक सुरक्षित बनवते.
जर ओझोन रेणू नष्ट झाला आणि O 2 सोडला गेला, तर ही प्रतिक्रिया नेहमी ऊर्जा सोडण्यासोबत असते. त्याच वेळी, उलट प्रक्रिया होण्यासाठी (O 2 वरून O 3 ची निर्मिती), ते कमी खर्च करणे आवश्यक आहे.

वायूच्या अवस्थेत, ओझोन रेणू 70 डिग्री सेल्सिअस तापमानात विघटित होतो. जर ते 100 अंश किंवा त्यापेक्षा जास्त वाढवले गेले तर प्रतिक्रिया लक्षणीयरीत्या गतीमान होईल. अशुद्धतेची उपस्थिती देखील ओझोन रेणूंच्या क्षय कालावधीला गती देते.
O3 गुणधर्म
ओझोन तीनपैकी कोणत्याही स्थितीत असला तरी तो त्याचा निळा रंग टिकवून ठेवतो. पदार्थ जितका कठिण, तितकी ही सावली अधिक समृद्ध आणि गडद.

प्रत्येक ओझोन रेणूचे वजन 48 ग्रॅम/मोल असते. हे हवेपेक्षा जड आहे, जे या पदार्थांना एकमेकांपासून वेगळे करण्यास मदत करते.
O 3 जवळजवळ सर्व धातू आणि नॉन-मेटल्स (सोने, इरिडियम आणि प्लॅटिनम वगळता) ऑक्सिडाइझ करण्यास सक्षम आहे.
तसेच, हा पदार्थ ज्वलन प्रतिक्रियेत भाग घेऊ शकतो, तथापि, यासाठी O 2 पेक्षा जास्त तापमान आवश्यक आहे.
ओझोन H 2 O आणि freons मध्ये विरघळण्यास सक्षम आहे. त्याच्या द्रव अवस्थेत, ते द्रव ऑक्सिजन, नायट्रोजन, मिथेन, आर्गॉन, कार्बन टेट्राक्लोराईड आणि कार्बन डायऑक्साइडसह मिसळले जाऊ शकते.
ओझोन रेणू कसा तयार होतो?
ऑक्सिजन रेणूंना मुक्त ऑक्सिजन अणू जोडून O 3 रेणू तयार होतात. ते, यामधून, इतर O 2 रेणूंच्या विभाजनामुळे त्यांच्यावरील विद्युत स्त्राव, अतिनील किरण, वेगवान इलेक्ट्रॉन आणि इतर उच्च ऊर्जा कणांच्या प्रभावामुळे दिसतात. या कारणास्तव, ओझोनचा विशिष्ट वास स्पार्किंग विद्युत उपकरणे किंवा अल्ट्राव्हायोलेट प्रकाश उत्सर्जित करणार्या दिव्यांजवळ जाणवू शकतो.

औद्योगिक स्तरावर, O 3 इलेक्ट्रिक किंवा ओझोनायझर्स वापरून वेगळे केले जाते. या उपकरणांमध्ये, उच्च-व्होल्टेज विद्युत प्रवाह ओ 2 असलेल्या वायू प्रवाहातून जातो, ज्याचे अणू ओझोनसाठी "बांधकाम साहित्य" म्हणून काम करतात.
कधीकधी शुद्ध ऑक्सिजन किंवा सामान्य हवा या उपकरणांमध्ये चालते. परिणामी ओझोनची गुणवत्ता प्रारंभिक उत्पादनाच्या शुद्धतेवर अवलंबून असते. तर, वैद्यकीय O 3, जखमांवर उपचार करण्यासाठी, केवळ रासायनिक शुद्ध O 2 पासून काढले जाते.
ओझोनच्या शोधाचा इतिहास
ओझोन रेणू कसा दिसतो आणि तो कसा तयार होतो हे शोधून काढल्यानंतर, या पदार्थाच्या इतिहासाशी परिचित होणे योग्य आहे.
18 व्या शतकाच्या उत्तरार्धात डच संशोधक मार्टिन व्हॅन मारुम यांनी प्रथम संश्लेषित केले होते. शास्त्रज्ञाच्या लक्षात आले की हवेसह कंटेनरमधून इलेक्ट्रिक स्पार्क गेल्यानंतर त्यातील वायूने त्याचे गुणधर्म बदलले. त्याच वेळी, व्हॅन मारुमला समजले नाही की त्याने नवीन पदार्थाचे रेणू वेगळे केले आहेत.
पण शीनबीन नावाच्या त्याच्या जर्मन सहकाऱ्याने, विजेच्या साहाय्याने H 2 O चे H आणि O 2 मध्ये विघटन करण्याचा प्रयत्न करून, तीव्र गंधासह नवीन वायू सोडण्याकडे लक्ष वेधले. बर्याच संशोधनानंतर, शास्त्रज्ञाने शोधलेल्या पदार्थाचे वर्णन केले आणि "गंध" या ग्रीक शब्दाच्या सन्मानार्थ त्याला "ओझोन" हे नाव दिले.
बुरशी आणि जीवाणू मारण्याची क्षमता तसेच खुल्या पदार्थात असलेल्या हानिकारक संयुगांची विषारीता कमी करण्याची क्षमता अनेक शास्त्रज्ञांना आवडली. O 3 च्या अधिकृत शोधानंतर 17 वर्षांनी, वर्नर फॉन सीमेन्सने पहिले उपकरण तयार केले ज्याने कोणत्याही प्रमाणात ओझोनचे संश्लेषण करणे शक्य केले. आणि 39 वर्षांनंतर, तेजस्वी निकोला टेस्लाने जगातील पहिल्या ओझोन जनरेटरचा शोध लावला आणि त्याचे पेटंट घेतले.
हेच उपकरण फ्रान्समध्ये 2 वर्षात पहिल्यांदा पिण्याच्या पाण्याच्या शुद्धीकरण केंद्रांवर वापरले गेले. XX शतकाच्या सुरुवातीपासून. युरोप त्याच्या शुद्धीकरणासाठी पिण्याच्या पाण्याच्या ओझोनेशनवर स्विच करू लागला आहे.
रशियन साम्राज्याने हे तंत्र प्रथम 1911 मध्ये वापरले आणि 5 वर्षांनंतर, ओझोन वापरून पिण्याच्या पाण्याच्या शुद्धीकरणासाठी जवळपास 4 डझन प्रतिष्ठान देशात सुसज्ज केले गेले.
आज, पाण्याचे ओझोनेशन हळूहळू क्लोरिनेशनची जागा घेत आहे. अशा प्रकारे, युरोपमधील सर्व पिण्याच्या पाण्यापैकी 95% ओ 3 ने उपचार केले जाते. हे तंत्र यूएसए मध्ये देखील खूप लोकप्रिय आहे. सीआयएसमध्ये, त्याचा अद्याप अभ्यास सुरू आहे कारण, जरी ही प्रक्रिया सुरक्षित आणि अधिक सोयीस्कर असली तरी ती क्लोरिनेशनपेक्षा महाग आहे.
ओझोन अनुप्रयोग
पाणी शुद्धीकरणाव्यतिरिक्त, O 3 मध्ये इतर अनेक अनुप्रयोग आहेत.
- ओझोनचा वापर कागद आणि कापडाच्या निर्मितीमध्ये ब्लीच म्हणून केला जातो.
- सक्रिय ऑक्सिजनचा वापर वाइन निर्जंतुक करण्यासाठी तसेच कॉग्नेक्सच्या वृद्धत्वाच्या प्रक्रियेस गती देण्यासाठी केला जातो.
- O 3 च्या मदतीने, विविध वनस्पती तेल शुद्ध केले जातात.
- बर्याचदा, हा पदार्थ नाशवंत उत्पादनांवर प्रक्रिया करण्यासाठी वापरला जातो, जसे की मांस, अंडी, फळे आणि भाज्या. क्लोरीन किंवा फॉर्मल्डिहाइडच्या वापराप्रमाणे ही प्रक्रिया रासायनिक ट्रेस सोडत नाही आणि उत्पादने जास्त काळ साठवली जाऊ शकतात.
- ओझोन वैद्यकीय उपकरणे आणि कपडे निर्जंतुक करते.
- तसेच, शुद्ध O 3 विविध वैद्यकीय आणि सौंदर्यप्रसाधन प्रक्रियेसाठी वापरले जाते. विशेषतः, दंतचिकित्सा मध्ये त्याच्या मदतीने, ते तोंडी पोकळी आणि हिरड्या निर्जंतुक करतात आणि विविध रोगांवर उपचार करतात (स्टोमाटायटीस, नागीण, तोंडी कॅंडिडिआसिस). युरोपियन देशांमध्ये, O 3 जखमेच्या निर्जंतुकीकरणासाठी खूप लोकप्रिय आहे.
- अलिकडच्या वर्षांत, ओझोन वापरून हवा आणि पाणी फिल्टर करण्यासाठी पोर्टेबल घरगुती उपकरणे प्रचंड लोकप्रिय झाली आहेत.
ओझोन थर - ते काय आहे?
पृथ्वीच्या पृष्ठभागापासून 15-35 किमी अंतरावर ओझोनचा थर आहे, किंवा त्याला ओझोनोस्फियर देखील म्हणतात. या ठिकाणी, केंद्रित O 3 हानिकारक सौर किरणोत्सर्गासाठी एक प्रकारचे फिल्टर म्हणून काम करते.

जर पदार्थाचे रेणू अस्थिर असतील तर एवढी रक्कम कोठून येते? जर आपल्याला ओझोन रेणूचे मॉडेल आणि त्याच्या निर्मितीची पद्धत आठवली तर या प्रश्नाचे उत्तर देणे कठीण नाही. तर, ऑक्सिजन, ज्यामध्ये 2 ऑक्सिजन रेणू असतात, स्ट्रॅटोस्फियरमध्ये प्रवेश करतात, तेथे सूर्याच्या किरणांमुळे गरम होते. ही ऊर्जा O 2 अणूंमध्ये विभाजित करण्यासाठी पुरेशी आहे, ज्यामधून O 3 तयार होतो. त्याच वेळी, ओझोन थर केवळ सौर ऊर्जेचा भाग वापरत नाही तर ते फिल्टर करते, धोकादायक अल्ट्राव्हायोलेट किरणोत्सर्ग शोषून घेते.
वर असे म्हटले होते की ओझोन फ्रीॉनद्वारे विरघळतो. हे वायू पदार्थ (डिओडोरंट्स, अग्निशामक आणि रेफ्रिजरेटर्सच्या निर्मितीमध्ये वापरले जातात), एकदा वातावरणात सोडले जातात, ओझोनवर परिणाम करतात आणि त्याचे विघटन करण्यास हातभार लावतात. परिणामी, ओझोनोस्फियरमध्ये छिद्रे दिसतात ज्याद्वारे फिल्टर न केलेले सौर किरण ग्रहामध्ये प्रवेश करतात, ज्याचा सजीवांवर विनाशकारी प्रभाव पडतो.
ओझोन रेणूंची वैशिष्ट्ये आणि रचना विचारात घेतल्यावर, आपण असा निष्कर्ष काढू शकतो की हा पदार्थ जरी धोकादायक असला तरी त्याचा योग्य वापर केल्यास मानवजातीसाठी खूप उपयुक्त आहे.