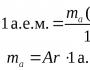வேதியியலில் சூத்திரங்களின் தொகுப்பு. சிக்கல்களைத் தீர்ப்பதற்கான அடிப்படை சூத்திரங்கள்
|
அளவு மற்றும் அதன் பரிமாணம் |
விகிதம் |
|
உறுப்பு X இன் அணு நிறை (உறவினர்) |
|
|
உறுப்பு வரிசை எண் |
Z= என்(இ –) = என்(ஆர் +) |
|
எக்ஸ் பொருளில் E இன் நிறை பின்னம், ஒரு அலகின் பின்னங்களில், % இல்) |
|
|
பொருளின் அளவு X, mol | |
|
வாயு பொருளின் அளவு, மோல் |
சரி. ஆர்– = 101 325 Pa,டி |
|
= 273 கே |
|
|
பொருளின் மோலார் நிறை X, g/mol, kg/mol |
மீபொருளின் நிறை X, g, kg (X) = n (X)எம் |
|
(எக்ஸ்) |
வி மீவாயுவின் மோலார் அளவு, l/mol, m 3 /mol |
|
= 22.4 l/mol N.S. |
வி = வி மீ × (X) = |
|
வாயு அளவு, மீ 3 |
|
|
தயாரிப்பு மகசூல் |
|
|
பொருளின் அடர்த்தி X, g/l, g/ml, kg/m 3 |
|
|
ஹைட்ரஜன் மூலம் X வாயுப் பொருளின் அடர்த்தி |
காற்றில் X வாயுப் பொருளின் அடர்த்திஎம் |
|
(காற்று) = 29 கிராம்/மோல் |
|
|
ஐக்கிய எரிவாயு சட்டம் |
மெண்டலீவ்-கிளாபிரான் சமன்பாடு = பி.வி, nRTஆர் |
|
= 8.314 J/mol×K |
|
|
வாயுக்களின் கலவையில் உள்ள ஒரு வாயுப் பொருளின் தொகுதிப் பகுதி, ஒரு அலகின் பின்னங்களில் அல்லது % இல் |
|
|
வாயுக்களின் கலவையின் மோலார் நிறை |
|
|
ஒரு கலவையில் உள்ள ஒரு பொருளின் மோல் பகுதி (X). |
வெப்ப அளவு, J, kJ = (X) = n வெப்ப அளவு, J, kJஎம் |
|
கே |
எதிர்வினையின் வெப்ப விளைவுகே =– |
|
எச் |
|
|
பொருள் X, J/mol, kJ/mol ஆகியவற்றின் உருவாக்கத்தின் வெப்பம் |
|
|
இரசாயன எதிர்வினை விகிதம் (mol/lsec) வெகுஜன நடவடிக்கை சட்டம் |
(ஒரு எளிய எதிர்வினைக்கு)அ A+வி பி=உடன் சி +ஈ டி = u பி= (ஒரு எளிய எதிர்வினைக்கு)கே பி= (A)வி |
|
(B) |
|
|
வான்ட் ஹாஃப் விதி |
|
|
பொருளின் கரைதிறன் (X) (g/100 g கரைப்பான்) |
|
|
A + X கலவையில் X பொருளின் நிறை பின்னம், ஒரு அலகின் பின்னங்களில், % இல் |
மீகரைசலின் எடை, கிராம், கிலோ மீ(rr) = மீ(X)+ மீகரைசலின் எடை, கிராம், கிலோ வி(H2O) (rr) |
|
(ஆர்ஆர்) |
|
|
கரைசலில் கரைந்த பொருளின் நிறை பின்னம், ஒரு அலகின் பின்னங்களில், % |
|
|
தீர்வு அடர்த்தி |
|
|
கரைசலின் அளவு, cm 3, l, m 3 |
|
|
மோலார் செறிவு, mol/l |
|
|
எலக்ட்ரோலைட் விலகலின் அளவு (X), ஒரு அலகு அல்லது % பின்னங்களில் |
நீரின் அயனி தயாரிப்புகே |
|
(H2O) = |
pH மதிப்பு |
pH = -lg
முக்கிய:குஸ்னெட்சோவா என்.இ. மற்றும் பல
. வேதியியல். 8 ஆம் வகுப்பு-10 ஆம் வகுப்பு - எம்.: வென்டானா-கிராஃப், 2005-2007.குஸ்னெட்சோவா என்.இ., லிட்வினோவா டி.என்., லெவ்கின் ஏ.என்.
வேதியியல்.2005-2007ல் 2 பாகங்களாக 11ம் வகுப்பு.எகோரோவ் ஏ.எஸ்.
வேதியியல். உயர்கல்விக்குத் தயாராகும் புதிய பாடநூல். ரோஸ்டோவ் n/d: பீனிக்ஸ், 2004.– 640 பக்.
வேதியியல்.2005-2007ல் 2 பாகங்களாக 11ம் வகுப்பு.எகோரோவ் ஏ.எஸ். வேதியியல்: ஒருங்கிணைந்த மாநிலத் தேர்வுக்குத் தயாராவதற்கான நவீன படிப்பு. ரோஸ்டோவ் n/a: பீனிக்ஸ், 2011. (2012) - 699 பக்.
இரசாயன சிக்கல்களைத் தீர்ப்பதற்கான சுய-அறிவுறுத்தல் கையேடு. - ரோஸ்டோவ்-ஆன்-டான்: பீனிக்ஸ், 2000. - 352 பக்.
பல்கலைக்கழகங்களுக்கு விண்ணப்பிப்பவர்களுக்கான வேதியியல்/ஆசிரியர் கையேடு. ரோஸ்டோவ்-என்/டி, பீனிக்ஸ், 2005– 536 ப. Khomchenko G.P., Khomchenko I.G.
. பல்கலைக்கழகங்களுக்கு விண்ணப்பிப்பவர்களுக்கு வேதியியலில் சிக்கல்கள். எம்.: மேல்நிலைப் பள்ளி. 2007.–302p.
கூடுதல்:. வேதியியலில் மையப்படுத்தப்பட்ட சோதனைக்குத் தயாரிப்பதற்கான கல்வி மற்றும் பயிற்சிப் பொருட்கள் / ஏ.ஐ. Vrublevsky –Mn.: Unipress LLC, 2004. – 368 p.
கூடுதல்:. பள்ளி குழந்தைகள் மற்றும் விண்ணப்பதாரர்களுக்கான மாற்றங்கள் மற்றும் கட்டுப்பாட்டு சோதனைகள் கொண்ட வேதியியலில் 1000 சிக்கல்கள்.
எகோரோவ் ஏ.எஸ்.. ஒருங்கிணைக்கப்பட்ட மாநில தேர்வுக்கான தயாரிப்பிற்கான வேதியியலில் அனைத்து வகையான கணக்கீடு சிக்கல்கள் - ரோஸ்டோவ் n / D: பீனிக்ஸ், 2003. - 320 ப.
எகோரோவ் ஏ.எஸ்., அமினோவா ஜி.கே.. வேதியியல் தேர்வுக்குத் தயாராவதற்கான வழக்கமான பணிகள் மற்றும் பயிற்சிகள். – ரோஸ்டோவ் n/d: பீனிக்ஸ், 2005. – 448 பக்.
ஒருங்கிணைந்த மாநிலத் தேர்வு 2007. வேதியியல். மாணவர்களைத் தயாரிப்பதற்கான கல்வி மற்றும் பயிற்சிப் பொருட்கள் / FIPI - M.: Intellect-Center, 2007. – 272 p.
ஒருங்கிணைந்த மாநிலத் தேர்வு 2011. வேதியியல். கல்வி மற்றும் பயிற்சி தொகுப்பு எட். ஏ.ஏ. காவேரினா - எம்.: தேசிய கல்வி, 2011.
ஒருங்கிணைந்த மாநிலத் தேர்வுக்குத் தயாராவதற்கான பணிகளுக்கான ஒரே உண்மையான விருப்பங்கள். ஒருங்கிணைந்த மாநிலத் தேர்வு 2007. வேதியியல்/வி.யு. மிஷினா, ஈ.என். ஸ்ட்ரெல்னிகோவா. எம்.: ஃபெடரல் டெஸ்டிங் சென்டர், 2007.–151 பக்.
காவேரினா ஏ.ஏ. மாணவர்களைத் தயார்படுத்துவதற்கான பணிகளின் உகந்த வங்கி. ஒருங்கிணைந்த மாநிலத் தேர்வு 2012. வேதியியல். பாடநூல்./ ஏ.ஏ. காவேரினா, டி.யு. டோப்ரோடின், யு.என். மெட்வெடேவ், எம்.ஜி. ஸ்னாஸ்டினா - எம்.: இன்டலெக்ட்-சென்டர், 2012. - 256 பக்.
லிட்வினோவா டி.என்., வைஸ்குபோவா என்.கே., அஜிபா எல்.டி., சோலோவியோவா எம்.வி.. 10-மாத கடிதத் தயாரிப்பு படிப்புகளின் மாணவர்களுக்கான சோதனைகளுக்கு கூடுதலாக சோதனை பணிகள் (முறையான வழிமுறைகள்). க்ராஸ்னோடர், 2004. – பி. 18 – 70.
லிட்வினோவா டி.என்.. வேதியியல். ஒருங்கிணைந்த மாநிலத் தேர்வு 2011. பயிற்சி சோதனைகள். ரோஸ்டோவ் n/d: பீனிக்ஸ், 2011.– 349 பக்.
லிட்வினோவா டி.என்.. வேதியியல். ஒருங்கிணைந்த மாநில தேர்வுக்கான சோதனைகள். ரோஸ்டோவ் என் / டி.: பீனிக்ஸ், 2012. - 284 பக்.
லிட்வினோவா டி.என்.. வேதியியல். விதிகள், தனிமங்களின் பண்புகள் மற்றும் அவற்றின் கலவைகள். ரோஸ்டோவ் என் / டி.: பீனிக்ஸ், 2012. - 156 பக்.
லிட்வினோவா டி.என்., மெல்னிகோவா ஈ.டி., சோலோவியோவா எம்.வி.., அஜிபா எல்.டி., வைஸ்குபோவா என்.கே.பல்கலைக்கழகங்களுக்கு விண்ணப்பிப்பவர்களுக்கான பணிகளில் வேதியியல்.
மருத்துவ மற்றும் உயிரியல் வகுப்புகளின் மாணவர்களுக்கான வேதியியலில் கல்வி மற்றும் முறைசார் வளாகம், பதிப்பு. டி.என்.லிட்வினோவா.: கே.எஸ்.எம்.யு., - 2008.
வேதியியல். ஒருங்கிணைந்த மாநிலத் தேர்வு 2008. நுழைவுத் தேர்வுகள், கற்பித்தல் உதவி / பதிப்பு. வி.என். டோரோன்கினா. – ரோஸ்டோவ் n/d: Legion, 2008.– 271 p.
வேதியியல் வலைத்தளங்களின் பட்டியல்:
1. அல்ஹிமிக். http:// www. அல்ஹிமிக். ru
2. அனைவருக்கும் வேதியியல். முழுமையான வேதியியல் பாடத்திற்கான மின்னணு குறிப்பு புத்தகம்.
http:// www. தகவல். ru/ உரை/ தரவுத்தளம்/ வேதியியல்/ START. html
3. பள்ளி வேதியியல் - குறிப்பு புத்தகம். http:// www. பள்ளி வேதியியல். மூலம். ru
4. வேதியியல் ஆசிரியர். http://www. chemistry.nm.ru
இணைய வளங்கள்
அல்ஹிமிக். http:// www. அல்ஹிமிக். ru
அனைவருக்கும் வேதியியல். முழுமையான வேதியியல் பாடத்திற்கான மின்னணு குறிப்பு புத்தகம்.
http:// www. தகவல். ru/ உரை/ தரவுத்தளம்/ வேதியியல்/ START. html
பள்ளி வேதியியல் - குறிப்பு புத்தகம். http:// www. பள்ளி வேதியியல். மூலம். ru
http://www.classchem.narod.ru
வேதியியல் ஆசிரியர். http://www. chemistry.nm.ru
http://www.alleng.ru/edu/chem.htm- வேதியியலில் கல்வி இணைய வளங்கள்
http://schoolchemistry.by.ru/- பள்ளி வேதியியல். இந்த தளத்தில் பல்வேறு தலைப்புகளில் ஆன்-லைன் சோதனையையும், ஒருங்கிணைந்த மாநில தேர்வின் டெமோ பதிப்புகளையும் எடுக்க வாய்ப்பு உள்ளது.
வேதியியல் மற்றும் வாழ்க்கை - XXI நூற்றாண்டு: பிரபலமான அறிவியல் இதழ். http:// www. ஹிஜ். ru
பள்ளி வேதியியல் பாடத்திற்கான அடிப்படை சூத்திரங்களின் தொகுப்பு
பள்ளி வேதியியல் பாடத்திற்கான அடிப்படை சூத்திரங்களின் தொகுப்பு
ஜி.பி. லோகினோவா
எலெனா சவின்கினா
ஈ.வி. சவின்கினா ஜி.பி. லோகினோவா
வேதியியலில் அடிப்படை சூத்திரங்களின் தொகுப்பு
மாணவர்களின் பாக்கெட் வழிகாட்டி
பொது வேதியியல்
மிக முக்கியமான வேதியியல் கருத்துக்கள் மற்றும் சட்டங்கள்
இரசாயன உறுப்பு- இது ஒரே அணுக்கரு கட்டணம் கொண்ட ஒரு குறிப்பிட்ட வகை அணு.
உறவினர் அணு நிறை(A r) கொடுக்கப்பட்ட வேதியியல் தனிமத்தின் அணுவின் நிறை, கார்பன்-12 அணுவின் (12 C) நிறைவை விட எத்தனை மடங்கு அதிகமாக உள்ளது என்பதைக் காட்டுகிறது.
இரசாயன பொருள்- எந்த இரசாயன துகள்களின் தொகுப்பு.
இரசாயன துகள்கள்
ஃபார்முலா அலகு- ஒரு வழக்கமான துகள், அதன் கலவை கொடுக்கப்பட்ட வேதியியல் சூத்திரத்திற்கு ஒத்திருக்கிறது, எடுத்துக்காட்டாக:Ar - ஆர்கான் பொருள் (Ar அணுக்கள் கொண்டது),
H 2 O - நீர் பொருள் (H 2 O மூலக்கூறுகள் கொண்டது),
KNO 3 - பொட்டாசியம் நைட்ரேட் பொருள் (K + கேஷன்ஸ் மற்றும் NO 3 ¯ அயனிகளைக் கொண்டுள்ளது).
உடல் அளவுகளுக்கு இடையிலான உறவுகள்
தனிமத்தின் அணு நிறை (உறவினர்).பி, ஏ ஆர் (பி):எங்கே *டி(அணு B) - உறுப்பு B இன் அணுவின் நிறை;
*t மற்றும்- அணு நிறை அலகு;
*t மற்றும் = 1/12 டி(12 C அணு) = 1.6610 24 கிராம்.
பொருளின் அளவு B, n(B), mol:
எங்கே N(B)- துகள்களின் எண்ணிக்கை பி;
என் ஏ– அவகாட்ரோவின் நிலையானது (N A = 6.0210 23 மோல் -1).
ஒரு பொருளின் மோலார் நிறை V, M(V), g/mol:
எங்கே t(V)- நிறை பி.
வாயுவின் மோலார் அளவு IN, வி எம் l/mol:
எங்கே வி எம் = 22.4 l/mol (அவோகாட்ரோ விதியின் விளைவு), சாதாரண நிலைமைகளின் கீழ் (n.s. - வளிமண்டல அழுத்தம் ப = 101,325 Pa (1 atm); வெப்ப இயக்க வெப்பநிலை டி = 273.15 K அல்லது செல்சியஸ் வெப்பநிலை t = 0 °C).
பி ஹைட்ரஜனுக்கு, டி(எச் 2 வாயு பி)
* வாயுப் பொருளின் அடர்த்தி IN விமானம் மூலம், டி(காற்றுக்கு மேல் எரிவாயு பி): தனிமத்தின் நிறை பின்னம்ஈ விஷயத்தில் V, w(E):x என்பது பொருள் B இன் சூத்திரத்தில் உள்ள E அணுக்களின் எண்ணிக்கை
அணுவின் அமைப்பு மற்றும் காலச் சட்டம் டி.ஐ. மெண்டலீவ்
நிறை எண் (A) - அணுக்கருவில் உள்ள புரோட்டான்கள் மற்றும் நியூட்ரான்களின் மொத்த எண்ணிக்கை:
A = N(p 0) + N(p +).
அணு அணுக்கரு கட்டணம் (Z)அணுக்கருவில் உள்ள புரோட்டான்களின் எண்ணிக்கை மற்றும் அணுவில் உள்ள எலக்ட்ரான்களின் எண்ணிக்கைக்கு சமம்:Z = N(p+) = N(e¯).
ஐசோடோப்புகள்- ஒரே தனிமத்தின் அணுக்கள், கருவில் உள்ள நியூட்ரான்களின் எண்ணிக்கையில் வேறுபடுகின்றன, எடுத்துக்காட்டாக: பொட்டாசியம்-39: 39 கே (19 ப + , 20n 0, 19e¯); பொட்டாசியம்-40: 40 K (19 p+, 21n 0, 19e¯).*ஆற்றல் நிலைகள் மற்றும் துணை நிலைகள்
*அணு சுற்றுப்பாதை(AO) ஒரு குறிப்பிட்ட ஆற்றலைக் கொண்ட எலக்ட்ரானின் நிகழ்தகவு அதிகமாக இருக்கும் இடத்தின் பகுதியை வகைப்படுத்துகிறது.*s- மற்றும் p-ஆர்பிட்டால்களின் வடிவங்கள்
காலச் சட்டம் மற்றும் காலமுறை அமைப்பு D.I. மெண்டலீவ்
தனிமங்களின் பண்புகள் மற்றும் அவற்றின் சேர்மங்கள் அதிகரித்து வரும் அணு எண்ணுடன் அவ்வப்போது மீண்டும் மீண்டும் செய்யப்படுகின்றன, இது தனிமத்தின் அணுவின் கருவின் கட்டணத்திற்கு சமம்.கால எண்பொருந்துகிறது எலக்ட்ரான்களால் நிரப்பப்பட்ட ஆற்றல் நிலைகளின் எண்ணிக்கை,மற்றும் நிற்கிறது நிரப்பப்பட வேண்டிய கடைசி ஆற்றல் நிலை(EU).
குழு எண் ஏகாட்டுகிறது மற்றும் முதலியன
குழு எண் பிகாட்டுகிறது வேலன்ஸ் எலக்ட்ரான்களின் எண்ணிக்கை nsமற்றும் (n – 1)d.
எஸ்-உறுப்புகள் பிரிவு- ஆற்றல் துணை நிலை (ESL) எலக்ட்ரான்களால் நிரப்பப்படுகிறது ns-EPU– IA- மற்றும் IIA-குழுக்கள், H மற்றும் He.
p-உறுப்புகள் பிரிவு- எலக்ட்ரான்களால் நிரப்பப்பட்டது np-EPU– IIIA-VIIIA-குழுக்கள்.
டி-உறுப்புகள் பிரிவு- எலக்ட்ரான்களால் நிரப்பப்பட்டது (பி- 1) d-EPU - IB-VIIIB2-குழுக்கள்.
f-உறுப்புகள் பிரிவு- எலக்ட்ரான்களால் நிரப்பப்பட்டது (பி-2) f-EPU - லாந்தனைடுகள் மற்றும் ஆக்டினைடுகள்.
கால அட்டவணையின் 3 வது காலகட்டத்தின் தனிமங்களின் ஹைட்ரஜன் சேர்மங்களின் கலவை மற்றும் பண்புகளில் மாற்றங்கள்
ஆவியாகாத, தண்ணீருடன் சிதைகிறது: NaH, MgH 2, AlH 3.ஆவியாகும்: SiH 4, PH 3, H 2 S, HCl.
கால அட்டவணையின் 3 வது காலகட்டத்தின் தனிமங்களின் அதிக ஆக்சைடுகள் மற்றும் ஹைட்ராக்சைடுகளின் கலவை மற்றும் பண்புகளில் மாற்றங்கள்
அடிப்படை: Na 2 O – NaOH, MgO – Mg(OH) 2.ஆம்போடெரிக்: Al 2 O 3 – Al(OH) 3.
அமிலம்: SiO 2 – H 4 SiO 4, P 2 O 5 – H 3 PO 4, SO 3 – H 2 SO 4, Cl 2 O 7 – HClO 4.
இரசாயன பிணைப்பு
எலக்ட்ரோநெக்டிவிட்டி(χ) என்பது ஒரு மூலக்கூறில் உள்ள அணுவின் எதிர்மறைக் கட்டணத்தைப் பெறுவதற்கான திறனைக் குறிக்கும் அளவு.கோவலன்ட் பிணைப்பு உருவாக்கத்தின் வழிமுறைகள்
பரிமாற்ற பொறிமுறை- அண்டை அணுக்களின் இரண்டு சுற்றுப்பாதைகளின் ஒன்றுடன் ஒன்று, ஒவ்வொன்றும் ஒரு எலக்ட்ரான் கொண்டது.நன்கொடையாளர்-ஏற்றுக்கொள்ளும் வழிமுறை- ஒரு ஜோடி எலக்ட்ரான்களைக் கொண்ட மற்றொரு அணுவின் சுற்றுப்பாதையுடன் ஒரு அணுவின் கட்டற்ற சுற்றுப்பாதையின் ஒன்றுடன் ஒன்று.
பிணைப்பு உருவாக்கத்தின் போது சுற்றுப்பாதைகளின் ஒன்றுடன் ஒன்று
*கலப்பினத்தின் வகை - துகள்களின் வடிவியல் வடிவம் - பிணைப்புகளுக்கு இடையிலான கோணம்
மைய அணு சுற்றுப்பாதைகளின் கலப்பினமாக்கல்- அவற்றின் ஆற்றல் மற்றும் வடிவத்தின் சீரமைப்பு.sp– நேரியல் – 180°
sp 2- முக்கோண - 120 °
sp 3- டெட்ராஹெட்ரல் - 109.5 °
sp 3 டி- முக்கோண-பைபிரமிடல் - 90 °; 120°
எஸ்பி 3 டி 2எண்முகம் - 90°
கலவைகள் மற்றும் தீர்வுகள்
தீர்வு- இரண்டு அல்லது அதற்கு மேற்பட்ட பொருட்களைக் கொண்ட ஒரே மாதிரியான அமைப்பு, அதன் உள்ளடக்கம் சில வரம்புகளுக்குள் மாறுபடும்.
தீர்வு:கரைப்பான் (எ.கா. நீர்) + கரைப்பான்.
உண்மையான தீர்வுகள் 1 நானோமீட்டருக்கும் குறைவான துகள்கள் உள்ளன.
கூழ் தீர்வுகள் 1 முதல் 100 நானோமீட்டர் அளவுள்ள துகள்கள் உள்ளன.
இயந்திர கலவைகள்(இடைநீக்கம்) 100 நானோமீட்டருக்கும் அதிகமான துகள்களைக் கொண்டுள்ளது.
இடைநீக்கம்=> திட + திரவம்
குழம்பு=> திரவம் + திரவம்
நுரை, மூடுபனி=> வாயு + திரவம்
பன்முக கலவைகள் பிரிக்கப்படுகின்றனதீர்வு மற்றும் வடிகட்டுதல்.
ஒரே மாதிரியான கலவைகள் பிரிக்கப்படுகின்றனஆவியாதல், வடித்தல், குரோமடோகிராபி.
நிறைவுற்ற தீர்வுகரைப்பானுடன் சமநிலையில் உள்ளது அல்லது இருக்கலாம்.
கரைதிறன்- கொடுக்கப்பட்ட வெப்பநிலையில் நிறைவுற்ற கரைசலில் கரைந்த பொருளின் உள்ளடக்கம்.
நிறைவுறா தீர்வு குறைவாக,
சூப்பர்சாச்சுரேட்டட் தீர்வுகரைப்பானைக் கொண்டுள்ளது மேலும்,கொடுக்கப்பட்ட வெப்பநிலையில் அதன் கரைதிறனை விட.
கரைசலில் உள்ள இயற்பியல் வேதியியல் அளவுகளுக்கு இடையிலான உறவுகள்
கரைப்பானின் நிறை பின்னம் IN, w(B);ஒரு யூனிட்டின் பின்னம் அல்லது %:எங்கே t(V)- நிறை பி,
t(r)- தீர்வு நிறை.
தீர்வு எடை, m(p), g:
m(p) = m(B) + m(H 2 O) = V(p) ρ(p),
F(p) என்பது தீர்வின் அளவு;ρ(p) - தீர்வு அடர்த்தி.
தீர்வு அளவு, V(p), l:
மோலார் செறிவு, s(V), mol/l:எங்கே n(B) என்பது பொருள் B இன் அளவு;
M(B) - பொருள் B இன் மோலார் நிறை.
தீர்வின் கலவையை மாற்றுதல்
கரைசலை தண்ணீரில் நீர்த்துப்போகச் செய்தல்:> t"(V)= t(B);
> கரைசலின் நிறை, சேர்க்கப்பட்ட நீரின் வெகுஜனத்தால் அதிகரிக்கிறது: m"(p) = m(p) + m(H 2 O).
ஒரு கரைசலில் இருந்து நீரை ஆவியாக்குதல்:
> கரைப்பானின் நிறை மாறாது: t"(B) = t(B).
> கரைசலின் நிறை ஆவியாக்கப்பட்ட நீரின் வெகுஜனத்தால் குறைகிறது: m"(p) = m(p) – m(H 2 O).
இரண்டு தீர்வுகளை ஒன்றிணைத்தல்:தீர்வுகளின் வெகுஜனங்களும், கரைந்த பொருளின் வெகுஜனங்களும் சேர்க்கப்படுகின்றன:
t"(B) = t(B) + t"(B);
t"(p) = t(p) + t"(p).
கிரிஸ்டல் டிராப்:கரைப்பானின் நிறை மற்றும் கரைசலின் நிறை ஆகியவை படிகங்களின் வெகுஜனத்தால் குறைக்கப்படுகின்றன:
m"(B) = m(B) – m(sediment); m"(p) = m(p) – m(sediment).
நீரின் நிறை மாறாது.
ஒரு வேதியியல் எதிர்வினையின் வெப்ப விளைவு
* ΔH என்ற பொருளின் உருவாக்கத்தின் என்டல்பி°(B), kJ/mol, என்பது ஒரு பொருளின் 1 மோல் அவற்றின் நிலையான நிலைகளில் இருந்து, அதாவது நிலையான அழுத்தத்தில் (அமைப்பில் உள்ள ஒவ்வொரு வாயுவிற்கும் 1 ஏடிஎம் அல்லது மொத்தத்தில்) இருந்து உருவாகும் எதிர்வினையின் என்டல்பி ஆகும். வாயு எதிர்வினை பங்கேற்பாளர்கள் இல்லாத நிலையில் 1 atm அழுத்தம் மற்றும் நிலையான வெப்பநிலை (பொதுவாக 298 K , அல்லது 25 °C).ஒரு இரசாயன எதிர்வினையின் வெப்ப விளைவு (ஹெஸ்ஸின் சட்டம்)
கே = ΣQ(தயாரிப்புகள்) - ΣQ(உருவிகள்).
ΔН° = ΣΔН°(தயாரிப்புகள்) - Σ ΔН°(உருவிகள்).
எதிர்வினைக்காக aA + bB +... = dD + eE +...ΔH° = (dΔH°(D) + eΔH°(E) +…) – (aΔH°(A) + bΔH°(B) +…),
எங்கே a, b, d, e- எதிர்வினை சமன்பாட்டில் உள்ள குணகங்களுடன் தொடர்புடைய பொருட்களின் ஸ்டோச்சியோமெட்ரிக் அளவுகள்.இரசாயன எதிர்வினை விகிதம்
தொகுதியில் τ நேரத்தில் இருந்தால் விΔ ஆல் மாற்றப்பட்ட எதிர்வினை அல்லது உற்பத்தியின் அளவு n,வேக எதிர்வினை:
மோனோமாலிகுலர் எதிர்வினைக்கு A → ...:
v = கே c(A)
இரு மூலக்கூறு எதிர்வினைக்கு A + B → ...:v = கே c(A) c(B).
மூன்று மூலக்கூறு எதிர்வினைக்கு A + B + C → ...:v = கே c(A) c(B) c(C).
ஒரு வேதியியல் எதிர்வினையின் வீதத்தை மாற்றுதல்
வேக எதிர்வினை அதிகரி:1) வேதியியல் ரீதியாக செயலில்எதிர்வினைகள்;
2) பதவி உயர்வுஎதிர்வினை செறிவுகள்;
3) அதிகரி
4) பதவி உயர்வுவெப்ப நிலை;
5) வினையூக்கிகள்.வேக எதிர்வினை குறைக்க:
1) வேதியியல் ரீதியாக செயலற்றஎதிர்வினைகள்;
2) பதவி இறக்கம்எதிர்வினை செறிவுகள்;
3) குறையும்திட மற்றும் திரவ உலைகளின் மேற்பரப்புகள்;
4) பதவி இறக்கம்வெப்ப நிலை;
5) தடுப்பான்கள்.
*வெப்பநிலை வேக குணகம்(γ) வெப்பநிலை பத்து டிகிரி அதிகரிக்கும் போது எதிர்வினை வீதம் எத்தனை முறை அதிகரிக்கிறது என்பதைக் காட்டும் எண்ணுக்குச் சமம்:
இரசாயன சமநிலை
வேதியியல் சமநிலைக்கான வெகுஜன நடவடிக்கை விதி:சமநிலை நிலையில், சமமான சக்திகளில் உள்ள பொருட்களின் மோலார் செறிவுகளின் உற்பத்தியின் விகிதம்
அவற்றின் ஸ்டோச்சியோமெட்ரிக் குணகங்கள், அவற்றின் ஸ்டோச்சியோமெட்ரிக் குணகங்களுக்கு சமமான சக்திகளில் உள்ள எதிர்வினைகளின் மோலார் செறிவுகளின் தயாரிப்புக்கு, ஒரு நிலையான வெப்பநிலையில் ஒரு நிலையான மதிப்பு. (செறிவு சமநிலை மாறிலி).
மீளக்கூடிய எதிர்வினைக்கான இரசாயன சமநிலை நிலையில்:
aA + bB + … ↔ dD + fF +…
K c = [D] d [F] f .../ [A] a [B] b ...
*பொருட்களின் உருவாக்கத்தை நோக்கி வேதியியல் சமநிலையில் மாற்றம்
1) எதிர்வினைகளின் செறிவு அதிகரிப்பு;2) தயாரிப்புகளின் செறிவைக் குறைத்தல்;
3) வெப்பநிலை அதிகரிப்பு (எண்டோதெர்மிக் எதிர்வினைக்கு);
4) வெப்பநிலையில் குறைவு (ஒரு வெப்ப எதிர்வினைக்கு);
5) அழுத்தம் அதிகரிப்பு (தொகுதி குறைவதால் ஏற்படும் எதிர்வினைக்கு);
6) அழுத்தம் குறைதல் (அளவு அதிகரிப்புடன் நிகழும் எதிர்வினைக்கு).
கரைசலில் எதிர்வினைகளை பரிமாறவும்
மின்னாற்பகுப்பு விலகல்- சில பொருட்கள் தண்ணீரில் கரைக்கப்படும் போது அயனிகள் (கேஷன்கள் மற்றும் அனான்கள்) உருவாகும் செயல்முறை.
அமிலங்கள்உருவாகின்றன ஹைட்ரஜன் கேஷன்ஸ்மற்றும் அமில அனான்கள்,உதாரணத்திற்கு:
HNO 3 = H + + NO 3 ¯
மின்னாற்பகுப்பு விலகலின் போது காரணங்கள்உருவாகின்றன உலோக கேஷன்ஸ்மற்றும் ஹைட்ராக்சைடு அயனிகள், எடுத்துக்காட்டாக:NaOH = Na + + OH¯
மின்னாற்பகுப்பு விலகலின் போது உப்புகள்(நடுத்தர, இரட்டை, கலப்பு) உருவாகின்றன உலோக கேஷன்ஸ்மற்றும் அமில அனான்கள், எடுத்துக்காட்டாக:NaNO 3 = Na + + NO 3 ¯
KAl(SO 4) 2 = K + + Al 3+ + 2SO 4 2-
மின்னாற்பகுப்பு விலகலின் போது அமில உப்புகள்உருவாகின்றன உலோக கேஷன்ஸ்மற்றும் அமில ஹைட்ரானியன்கள், எடுத்துக்காட்டாக:NaHCO 3 = Na + + HCO 3 ‾
சில வலுவான அமிலங்கள்
HBr, HCl, HClO 4, H 2 Cr 2 O 7, HI, HMnO 4, H 2 SO 4, H 2 SeO 4, HNO 3, H 2 CrO 4சில வலுவான காரணங்கள்
RbOH, CsOH, KOH, NaOH, LiOH, Ba(OH) 2, Sr(OH) 2, Ca(OH) 2விலகல் பட்டம் α- ஆரம்ப துகள்களின் எண்ணிக்கையுடன் பிரிக்கப்பட்ட துகள்களின் எண்ணிக்கையின் விகிதம்.
நிலையான தொகுதியில்:
விலகல் அளவு மூலம் பொருட்களின் வகைப்பாடு
பெர்தோலெட்டின் விதி
ஒரு வீழ்படிவு, வாயு அல்லது பலவீனமான எலக்ட்ரோலைட் உருவானால் கரைசலில் பரிமாற்ற எதிர்வினைகள் மீளமுடியாமல் தொடர்கின்றன.மூலக்கூறு மற்றும் அயனி எதிர்வினை சமன்பாடுகளின் எடுத்துக்காட்டுகள்
1. மூலக்கூறு சமன்பாடு: CuCl 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaCl“முழுமையான” அயனிச் சமன்பாடு: Сu 2+ + 2Сl¯ + 2Na + + 2OH¯ = Cu(OH) 2 ↓ + 2Na + + 2Сl¯
“குறுகிய” அயனிச் சமன்பாடு: Cu 2+ + 2OH¯ = Cu(OH) 2 ↓
2. மூலக்கூறு சமன்பாடு: FeS (T) + 2HCl = FeCl 2 + H 2 S
“முழுமையான” அயனிச் சமன்பாடு: FeS + 2H + + 2Сl¯ = Fe 2+ + 2Сl¯ + H 2 S
“குறுகிய” அயனிச் சமன்பாடு: FeS (T) + 2H + = Fe 2+ + H 2 S
3. மூலக்கூறு சமன்பாடு: 3HNO 3 + K 3 PO 4 = H 3 PO 4 + 3KNO 3
"முழுமையான" அயனிச் சமன்பாடு: 3H + + 3NO 3 ¯ + 3K + + PO 4 3- = H 3 PO 4 + 3K + + 3NO 3 ¯
"குறுகிய" அயனிச் சமன்பாடு: 3H + + PO 4 3- = H 3 PO 4
* ஹைட்ரஜன் குறியீடு
(pH) pH = – பதிவு = 14 + பதிவு*நீர்த்த நீர் கரைசல்களுக்கான pH வரம்பு
pH 7 (நடுநிலை சூழல்)பரிமாற்ற எதிர்வினைகளின் எடுத்துக்காட்டுகள்
நடுநிலைப்படுத்தல் எதிர்வினை- ஒரு அமிலமும் அடித்தளமும் தொடர்பு கொள்ளும்போது ஏற்படும் பரிமாற்ற எதிர்வினை.1. காரம் + வலுவான அமிலம்: Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Ba 2+ + 2ON¯ + 2H + + 2Сl¯ = Ba 2+ + 2Сl¯ + 2Н 2 O
H + + OH¯ = H 2 O
2. சிறிது கரையக்கூடிய அடிப்படை + வலுவான அமிலம்: Cu(OH) 2(t) + 2HCl = CuCl 2 + 2H 2 O
Cu(OH) 2 + 2H + + 2Cl¯ = Cu 2+ + 2Cl¯ + 2H 2 O
Cu(OH) 2 + 2H + = Cu 2+ + 2H 2 O
* நீராற்பகுப்பு- அணுக்களின் ஆக்சிஜனேற்ற நிலைகளை மாற்றாமல் ஒரு பொருளுக்கும் தண்ணீருக்கும் இடையிலான பரிமாற்ற எதிர்வினை.
1. பைனரி சேர்மங்களின் மீளமுடியாத நீராற்பகுப்பு:
Mg 3 N 2 + 6H 2 O = 3Mg(OH) 2 + 2NH 3
2. உப்புகளின் மீளக்கூடிய நீராற்பகுப்பு:
A) உப்பு உருவாகிறது ஒரு வலுவான அடிப்படை கேஷன் மற்றும் வலுவான அமில அயனி:
NaCl = Na + + Сl¯
Na + + H 2 O ≠ ;
Cl¯ + H 2 O ≠
நீர்ப்பகுப்பு இல்லை; நடுநிலை சூழல், pH = 7.
B) உப்பு உருவாகிறது ஒரு வலுவான அடிப்படை கேஷன் மற்றும் பலவீனமான அமில அயனி:
Na 2 S = 2Na + + S 2-
Na + + H 2 O ≠
S 2- + H 2 O ↔ HS¯ + OH¯
அயனி மூலம் நீராற்பகுப்பு; கார சூழல், pH >7.
B) உப்பு உருவாகிறது பலவீனமான அல்லது சிறிது கரையக்கூடிய தளத்தின் கேஷன் மற்றும் வலுவான அமிலத்தின் அயனி:
அறிமுக துண்டின் முடிவு.
லிட்டர் LLC வழங்கிய உரை.
விசா, மாஸ்டர்கார்டு, மேஸ்ட்ரோ வங்கி அட்டை, மொபைல் ஃபோன் கணக்கிலிருந்து, பேமெண்ட் டெர்மினலில் இருந்து, MTS அல்லது Svyaznoy கடையில், PayPal, WebMoney, Yandex.Money, QIWI Wallet, போனஸ் கார்டுகள் அல்லது உங்களுக்கு வசதியான மற்றொரு முறை.
தகவலை சரிபார்க்கவும். இந்த கட்டுரையில் வழங்கப்பட்ட தகவல்களின் உண்மைகள் மற்றும் நம்பகத்தன்மையின் துல்லியத்தை சரிபார்க்க வேண்டியது அவசியம். பேச்சுப் பக்கத்தில், கலைச்சொற்கள் தொடர்பான சந்தேகங்கள் என்ற தலைப்பில் விவாதம் உள்ளது. இரசாயன சூத்திரம் ... விக்கிபீடியா
ஒரு வேதியியல் சூத்திரம் இரசாயன குறியீடுகள், எண்கள் மற்றும் அடைப்புக்குறிகளின் பிரிக்கும் சின்னங்களைப் பயன்படுத்தி பொருட்களின் கலவை மற்றும் அமைப்பு பற்றிய தகவலை பிரதிபலிக்கிறது. தற்போது, பின்வரும் வகையான இரசாயன சூத்திரங்கள் வேறுபடுகின்றன: எளிமையான சூத்திரம். அனுபவம் வாய்ந்தவர்கள் மூலம் பெறலாம்... ... விக்கிபீடியா
ஒரு வேதியியல் சூத்திரம் இரசாயன குறியீடுகள், எண்கள் மற்றும் அடைப்புக்குறிகளின் பிரிக்கும் சின்னங்களைப் பயன்படுத்தி பொருட்களின் கலவை மற்றும் அமைப்பு பற்றிய தகவலை பிரதிபலிக்கிறது. தற்போது, பின்வரும் வகையான இரசாயன சூத்திரங்கள் வேறுபடுகின்றன: எளிமையான சூத்திரம். அனுபவம் வாய்ந்தவர்கள் மூலம் பெறலாம்... ... விக்கிபீடியா
ஒரு வேதியியல் சூத்திரம் இரசாயன குறியீடுகள், எண்கள் மற்றும் அடைப்புக்குறிகளின் பிரிக்கும் சின்னங்களைப் பயன்படுத்தி பொருட்களின் கலவை மற்றும் அமைப்பு பற்றிய தகவலை பிரதிபலிக்கிறது. தற்போது, பின்வரும் வகையான இரசாயன சூத்திரங்கள் வேறுபடுகின்றன: எளிமையான சூத்திரம். அனுபவம் வாய்ந்தவர்கள் மூலம் பெறலாம்... ... விக்கிபீடியா
ஒரு வேதியியல் சூத்திரம் இரசாயன குறியீடுகள், எண்கள் மற்றும் அடைப்புக்குறிகளின் பிரிக்கும் சின்னங்களைப் பயன்படுத்தி பொருட்களின் கலவை மற்றும் அமைப்பு பற்றிய தகவலை பிரதிபலிக்கிறது. தற்போது, பின்வரும் வகையான இரசாயன சூத்திரங்கள் வேறுபடுகின்றன: எளிமையான சூத்திரம். அனுபவம் வாய்ந்தவர்கள் மூலம் பெறலாம்... ... விக்கிபீடியா
முதன்மைக் கட்டுரை: கனிம சேர்மங்கள் தனிமத்தின் மூலம் கனிம சேர்மங்களின் பட்டியல், ஒவ்வொரு பொருளுக்கும் அகரவரிசையில் (சூத்திரத்தின்படி) வழங்கப்பட்ட கனிம சேர்மங்களின் தகவல் பட்டியல், தனிமங்களின் ஹைட்ரஜன் அமிலங்கள் (என்றால் ... ... விக்கிபீடியா
இந்தக் கட்டுரை அல்லது பகுதி மீள்திருத்தம் தேவை. கட்டுரைகள் எழுதுவதற்கான விதிகளின்படி கட்டுரையை மேம்படுத்தவும்... விக்கிபீடியா
ஒரு இரசாயன சமன்பாடு (ஒரு இரசாயன எதிர்வினையின் சமன்பாடு) என்பது வேதியியல் சூத்திரங்கள், எண் குணகங்கள் மற்றும் கணித குறியீடுகளைப் பயன்படுத்தி ஒரு இரசாயன எதிர்வினையின் வழக்கமான பிரதிநிதித்துவமாகும். ஒரு இரசாயன எதிர்வினை சமன்பாடு தரம் மற்றும் அளவு கொடுக்கிறது... ... விக்கிபீடியா
வேதியியல் மென்பொருள் என்பது வேதியியல் துறையில் பயன்படுத்தப்படும் கணினி நிரல்களாகும். பொருளடக்கம் 1 இரசாயன ஆசிரியர்கள் 2 தளங்கள் 3 இலக்கியம் ... விக்கிபீடியா
புத்தகங்கள்
- தொழில்துறை உபகரணங்களை நிறுவுவதற்கான ஜப்பானிய-ஆங்கிலம்-ரஷ்ய அகராதி. சுமார் 8,000 சொற்கள், Popova I.S என்பது பரந்த அளவிலான பயனர்களுக்காகவும், முதன்மையாக ஜப்பானில் இருந்து தொழில்துறை உபகரணங்களை வழங்குதல் மற்றும் செயல்படுத்துவதில் ஈடுபட்டுள்ள மொழிபெயர்ப்பாளர்கள் மற்றும் தொழில்நுட்ப வல்லுநர்களுக்காகவும் வடிவமைக்கப்பட்டுள்ளது.
- உயிர்வேதியியல் சொற்களின் சுருக்கமான அகராதி, குனிஷேவ் எஸ்.எம்.. இந்த அகராதி பொது உயிர்வேதியியல், சூழலியல் மற்றும் உயிரி தொழில்நுட்பத்தின் அடிப்படைகள் ஆகியவற்றில் படிப்பைப் படிக்கும் பல்கலைக்கழகங்களில் இரசாயன மற்றும் உயிரியல் சிறப்பு மாணவர்களுக்காக வடிவமைக்கப்பட்டுள்ளது, மேலும் இதைப் பயன்படுத்தலாம் ...
பல அடிப்படை கருத்துக்கள் மற்றும் சூத்திரங்கள்.
அனைத்து பொருட்களும் வெவ்வேறு நிறை, அடர்த்தி மற்றும் அளவு கொண்டவை. ஒரு தனிமத்தின் ஒரு உலோகத் துண்டு மற்றொரு உலோகத்தின் அதே அளவிலான துண்டை விட பல மடங்கு எடையுள்ளதாக இருக்கும்.
மச்சம்(மோல்களின் எண்ணிக்கை)
பதவி: மச்சம், சர்வதேச: mol- ஒரு பொருளின் அளவை அளவிடும் அலகு. கொண்டிருக்கும் பொருளின் அளவை ஒத்துள்ளது என்.ஏ.துகள்கள் (மூலக்கூறுகள், அணுக்கள், அயனிகள்) எனவே, ஒரு உலகளாவிய அளவு அறிமுகப்படுத்தப்பட்டது - மச்சங்களின் எண்ணிக்கை.பணிகளில் அடிக்கடி சந்திக்கும் சொற்றொடர் "பெறப்பட்டது... பொருளின் மச்சம்"
என்.ஏ.= 6.02 1023
என்.ஏ.- அவகாட்ரோ எண். மேலும் "ஒப்பந்தத்தின்படி ஒரு எண்." ஒரு பென்சிலின் நுனியில் எத்தனை அணுக்கள் உள்ளன? சுமார் ஆயிரம். அத்தகைய அளவுகளுடன் செயல்பட வசதியாக இல்லை. எனவே, உலகெங்கிலும் உள்ள வேதியியலாளர்கள் மற்றும் இயற்பியலாளர்கள் ஒப்புக்கொண்டனர் - 6.02 × 1023 துகள்களை (அணுக்கள், மூலக்கூறுகள், அயனிகள்) எனக் குறிப்பிடுவோம். 1 மச்சம் பொருட்கள்.
1 மோல் = 6.02 1023 துகள்கள்
பிரச்சனைகளைத் தீர்ப்பதற்கான அடிப்படை சூத்திரங்களில் இதுவே முதன்மையானது.
ஒரு பொருளின் மோலார் நிறை
மோலார் நிறைபொருள் என்பது ஒன்றின் நிறை பொருளின் மச்சம்.
திரு என குறிப்பிடப்படுகிறது. இது கால அட்டவணையின்படி காணப்படுகிறது - இது ஒரு பொருளின் அணு வெகுஜனங்களின் கூட்டுத்தொகையாகும்.
உதாரணமாக, நமக்கு சல்பூரிக் அமிலம் - H2SO4 வழங்கப்படுகிறது. ஒரு பொருளின் மோலார் வெகுஜனத்தைக் கணக்கிடுவோம்: அணு நிறை H = 1, S-32, O-16.
திரு(H2SO4)=1 2+32+16 4=98 g\mol.
சிக்கல்களைத் தீர்ப்பதற்கு தேவையான இரண்டாவது சூத்திரம்
பொருள் நிறை சூத்திரம்:
அதாவது, ஒரு பொருளின் வெகுஜனத்தைக் கண்டுபிடிக்க, நீங்கள் மோல்களின் (n) எண்ணிக்கையை அறிந்து கொள்ள வேண்டும், மேலும் கால அட்டவணையில் இருந்து மோலார் வெகுஜனத்தைக் கண்டுபிடிப்போம்.
நிறை பாதுகாப்பு சட்டம் -ஒரு வேதியியல் எதிர்வினைக்குள் நுழையும் பொருட்களின் நிறை எப்போதும் விளைந்த பொருட்களின் வெகுஜனத்திற்கு சமமாக இருக்கும்.
வினைபுரிந்த பொருட்களின் நிறை(கள்) தெரிந்தால், அந்த வினையின் விளைபொருட்களின் நிறை(கள்) கண்டுபிடிக்கலாம். மற்றும் நேர்மாறாகவும்.
வேதியியல் சிக்கல்களைத் தீர்ப்பதற்கான மூன்றாவது சூத்திரம்
பொருளின் அளவு:
மன்னிக்கவும், இந்தப் படம் எங்களின் வழிகாட்டுதல்களைப் பூர்த்தி செய்யவில்லை. தொடர்ந்து வெளியிட, படத்தை நீக்கவும் அல்லது வேறொன்றைப் பதிவேற்றவும்.22.4 என்ற எண் எங்கிருந்து வந்தது? இருந்து அவகாட்ரோ விதி:
ஒரே வெப்பநிலை மற்றும் அழுத்தத்தில் எடுக்கப்பட்ட வெவ்வேறு வாயுக்களின் சம அளவுகளில் ஒரே எண்ணிக்கையிலான மூலக்கூறுகள் உள்ளன.
அவகாட்ரோ விதியின்படி, சாதாரண நிலைகளில் (என்.எஸ்.) ஒரு சிறந்த வாயுவின் 1 மோல் ஒரே அளவைக் கொண்டுள்ளது. Vm= 22.413 996(39) எல்
அதாவது, சிக்கலில் நமக்கு சாதாரண நிலைமைகள் வழங்கப்பட்டால், மோல்களின் (n) எண்ணிக்கையை அறிந்து, பொருளின் அளவைக் கண்டறியலாம்.
அதனால், பிரச்சனைகளை தீர்ப்பதற்கான அடிப்படை சூத்திரங்கள்வேதியியலில்
அவகாட்ரோவின் எண்என்.ஏ.
6.02 1023 துகள்கள்
பொருளின் அளவு n (mol)
n=V\22.4 (l\mol)
பொருள் நிறைமீ (கிராம்)
பொருளின் அளவு V(எல்)
V=n 22.4 (l\mol)
மன்னிக்கவும், இந்தப் படம் எங்களின் வழிகாட்டுதல்களைப் பூர்த்தி செய்யவில்லை. தொடர்ந்து வெளியிட, படத்தை நீக்கவும் அல்லது வேறொன்றைப் பதிவேற்றவும்.இவை சூத்திரங்கள். பெரும்பாலும், சிக்கல்களைத் தீர்க்க, நீங்கள் முதலில் எதிர்வினை சமன்பாட்டை எழுத வேண்டும் மற்றும் (தேவை!) குணகங்களை ஏற்பாடு செய்ய வேண்டும் - அவற்றின் விகிதம் செயல்பாட்டில் உள்ள மோல்களின் விகிதத்தை தீர்மானிக்கிறது.
முக்கிய வார்த்தைகள்: வேதியியல் 8 ஆம் வகுப்பு. அனைத்து சூத்திரங்கள் மற்றும் வரையறைகள், உடல் அளவுகளின் சின்னங்கள், அளவீட்டு அலகுகள், அளவீட்டு அலகுகளை நியமிப்பதற்கான முன்னொட்டுகள், அலகுகளுக்கு இடையிலான உறவுகள், இரசாயன சூத்திரங்கள், அடிப்படை வரையறைகள், சுருக்கமாக, அட்டவணைகள், வரைபடங்கள்.
1. சின்னங்கள், பெயர்கள் மற்றும் அளவீட்டு அலகுகள்
வேதியியலில் பயன்படுத்தப்படும் சில உடல் அளவுகள்
| உடல் அளவு | பதவி | அலகு |
| நேரம் | டி | பி= |
| அழுத்தம் | ப | பா, கேபிஏ |
| பொருளின் அளவு | ν | மச்சம் |
| பொருள் நிறை | மீ | கிலோ, கிராம் |
| நிறை பின்னம் | ω | பரிமாணமற்றது |
| மோலார் நிறை | எம் | கிலோ/மோல், ஜி/மோல் |
| மோலார் தொகுதி | Vn | மீ 3 / மோல், எல் / மோல் |
| பொருளின் அளவு | வி | மீ 3, எல் |
| தொகுதி பின்னம் | பரிமாணமற்றது | |
| உறவினர் அணு நிறை | ஏ ஆர் | பரிமாணமற்றது |
| திரு | பரிமாணமற்றது | |
| வாயு A மற்றும் வாயு B க்கு ஒப்பீட்டு அடர்த்தி | டிபி (ஏ) | பரிமாணமற்றது |
| பொருளின் அடர்த்தி | ஆர் | kg/m 3, g/cm 3, g/ml |
| அவகாட்ரோவின் நிலையானது | என் ஏ | 1/mol |
| முழுமையான வெப்பநிலை | டி | கே (கெல்வின்) |
| செல்சியஸில் வெப்பநிலை | டி | °C (டிகிரி செல்சியஸ்) |
| ஒரு வேதியியல் எதிர்வினையின் வெப்ப விளைவு | கே | kJ/mol |

2. உடல் அளவுகளின் அலகுகளுக்கு இடையிலான உறவுகள்

3. 8 ஆம் வகுப்பில் இரசாயன சூத்திரங்கள்
4. 8 ஆம் வகுப்பில் அடிப்படை வரையறைகள்

- அணு- ஒரு பொருளின் வேதியியல் ரீதியாக பிரிக்க முடியாத சிறிய துகள்.
- இரசாயன உறுப்பு- ஒரு குறிப்பிட்ட வகை அணு.
- மூலக்கூறு- ஒரு பொருளின் மிகச்சிறிய துகள் அதன் கலவை மற்றும் வேதியியல் பண்புகளைத் தக்கவைத்து அணுக்களைக் கொண்டுள்ளது.
- எளிய பொருட்கள்- மூலக்கூறுகள் ஒரே வகை அணுக்களைக் கொண்ட பொருட்கள்.
- சிக்கலான பொருட்கள்- மூலக்கூறுகள் பல்வேறு வகையான அணுக்களைக் கொண்ட பொருட்கள்.
- பொருளின் தரமான கலவை இது எந்த உறுப்புகளின் அணுக்களைக் கொண்டுள்ளது என்பதைக் காட்டுகிறது.
- பொருளின் அளவு கலவை ஒவ்வொரு தனிமத்தின் அணுக்களின் எண்ணிக்கையை அதன் கலவையில் காட்டுகிறது.
- இரசாயன சூத்திரம்- இரசாயன குறியீடுகள் மற்றும் குறியீடுகளைப் பயன்படுத்தி ஒரு பொருளின் தரம் மற்றும் அளவு கலவையின் வழக்கமான பதிவு.
- அணு நிறை அலகு(அமு) - அணு நிறை அளவீட்டு அலகு, ஒரு கார்பன் அணுவின் 1/12 நிறை 12 சி.
- மச்சம்- 0.012 கிலோ கார்பன் 12 C இல் உள்ள அணுக்களின் எண்ணிக்கைக்கு சமமான பல துகள்களைக் கொண்ட ஒரு பொருளின் அளவு.
- அவகாட்ரோவின் நிலையானது (நா = 6*10 23 மோல் -1) - ஒரு மோலில் உள்ள துகள்களின் எண்ணிக்கை.
- ஒரு பொருளின் மோலார் நிறை (காற்றில் X வாயுப் பொருளின் அடர்த்தி ) என்பது 1 மோல் அளவில் எடுக்கப்பட்ட பொருளின் நிறை.
- உறவினர் அணு நிறைஉறுப்பு ஏ ஆர் - கொடுக்கப்பட்ட தனிமத்தின் அணுவின் நிறை விகிதம் m 0 முதல் 1/12 கார்பன் அணுவின் நிறை 12 C.
- தொடர்புடைய மூலக்கூறு எடைபொருட்கள் காற்றில் X வாயுப் பொருளின் அடர்த்தி ஆர் - கொடுக்கப்பட்ட பொருளின் மூலக்கூறின் நிறை விகிதம் ஒரு கார்பன் அணுவின் 1/12 க்கு 12 C. ஒப்பீட்டு மூலக்கூறு நிறை என்பது கலவையை உருவாக்கும் வேதியியல் கூறுகளின் ஒப்பீட்டு அணு வெகுஜனங்களின் கூட்டுத்தொகைக்கு சமம். கொடுக்கப்பட்ட தனிமத்தின் அணுக்களின் எண்ணிக்கையை கணக்கில் கொள்ள வேண்டும்.
- நிறை பின்னம்இரசாயன உறுப்பு ω(X)கொடுக்கப்பட்ட உறுப்பு மூலம் X பொருளின் தொடர்புடைய மூலக்கூறு வெகுஜனத்தின் எந்தப் பகுதி கணக்கிடப்படுகிறது என்பதைக் காட்டுகிறது.
அணு-மூலக்கூறு கற்பித்தல்
1. மூலக்கூறு மற்றும் மூலக்கூறு அல்லாத அமைப்பு கொண்ட பொருட்கள் உள்ளன.
2. மூலக்கூறுகளுக்கு இடையில் இடைவெளிகள் உள்ளன, அவற்றின் அளவுகள் பொருள் மற்றும் வெப்பநிலையின் ஒருங்கிணைப்பின் நிலையைப் பொறுத்தது.
3. மூலக்கூறுகள் தொடர்ச்சியான இயக்கத்தில் உள்ளன.
4. மூலக்கூறுகள் அணுக்களால் ஆனவை.
6. அணுக்கள் ஒரு குறிப்பிட்ட நிறை மற்றும் அளவு ஆகியவற்றால் வகைப்படுத்தப்படுகின்றன.
இயற்பியல் நிகழ்வுகளின் போது, மூலக்கூறுகள் இரசாயன நிகழ்வுகளின் போது பாதுகாக்கப்படுகின்றன, ஒரு விதியாக, அவை அழிக்கப்படுகின்றன. வேதியியல் நிகழ்வுகளின் போது அணுக்கள் மறுசீரமைக்கப்படுகின்றன, புதிய பொருட்களின் மூலக்கூறுகளை உருவாக்குகின்றன.

பொருளின் நிலையான கலவையின் சட்டம்
மூலக்கூறு கட்டமைப்பின் ஒவ்வொரு வேதியியல் தூய்மையான பொருளும், தயாரிப்பு முறையைப் பொருட்படுத்தாமல், நிலையான தரம் மற்றும் அளவு கலவையைக் கொண்டுள்ளது.
VALENCE
வேலன்ஸ் என்பது ஒரு வேதியியல் தனிமத்தின் ஒரு அணுவின் சொத்து, மற்றொரு தனிமத்தின் குறிப்பிட்ட எண்ணிக்கையிலான அணுக்களை இணைக்க அல்லது மாற்றுகிறது.

இரசாயன எதிர்வினை
ஒரு வேதியியல் எதிர்வினை என்பது ஒரு நிகழ்வாகும், இதன் விளைவாக ஒரு பொருளில் இருந்து மற்ற பொருட்கள் உருவாகின்றன. எதிர்வினைகள் ஒரு இரசாயன எதிர்வினைக்குள் நுழையும் பொருட்கள். எதிர்வினை தயாரிப்புகள் ஒரு எதிர்வினையின் விளைவாக உருவாகும் பொருட்கள்.
இரசாயன எதிர்வினைகளின் அறிகுறிகள்:
1. வெப்பம் (ஒளி) வெளியீடு.
2. நிறத்தில் மாற்றம்.
3. நாற்றம் தோன்றுகிறது.
4. வண்டல் உருவாக்கம்.
5. எரிவாயு வெளியீடு.




 வி மீ= 22.4 l/mol (n.s.)
வி மீ= 22.4 l/mol (n.s.)