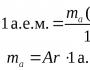Kokoelma kemian kaavoja. Peruskaavat ongelmien ratkaisemiseen
|
Suuruus ja sen ulottuvuus |
Suhde |
|
Alkuaineen X atomimassa (suhteellinen) |
|
|
Elementin sarjanumero |
Z= N(e –) = N(R +) |
|
Alkuaineen E massaosuus aineessa X, yksikön murto-osina, prosentteina |
|
|
Aineen määrä X, mol | |
|
Kaasuaineen määrä, mol |
Hyvin. – R= 101 325 Pa, T= 273 K |
|
Aineen X moolimassa, g/mol, kg/mol |
|
|
Aineen massa X, g, kg |
m(X) = n(X) M(X) |
|
Kaasun moolitilavuus, l/mol, m 3 /mol |
V m= 22,4 l/mol N.S. |
|
Kaasun tilavuus, m 3 |
V = V m × n |
|
Tuotteen tuotto |
|
|
Aineen X tiheys, g/l, g/ml, kg/m 3 |
|
|
Kaasumaisen aineen X tiheys vedyn vaikutuksesta |
|
|
Kaasumaisen aineen X tiheys ilmassa |
M(ilma) = 29 g/mol |
|
Yhdistynyt kaasulaki |
|
|
Mendelejev-Clapeyron yhtälö |
PV = nRT, R= 8,314 J/mol × K |
|
Kaasumaisen aineen tilavuusosuus kaasuseoksessa, yksikön jakeina tai % |
|
|
Kaasuseoksen moolimassa |
|
|
Aineen mooliosuus (X) seoksessa |
|
|
Lämmön määrä, J, kJ |
K = n(X) K(X) |
|
Reaktion lämpövaikutus |
Q =-H |
|
Aineen X muodostumislämpö, J/mol, kJ/mol |
|
|
Kemiallinen reaktionopeus (mol/ls) |
|
|
Joukkotoiminnan laki (yksinkertaista reaktiota varten) |
a A+ V B= Kanssa C + d D u = k Kanssa a(A) Kanssa V(B) |
|
Van't Hoffin sääntö |
|
|
Aineen liukoisuus (X) (g/100 g liuotinta) |
|
|
Aineen X massaosuus seoksessa A + X, yksikön osina, % |
|
|
Liuoksen paino, g, kg |
m(rr) = m(X)+ m(H2O) m(rr) = V(rr) (rr) |
|
Liuenneen aineen massaosuus liuoksessa, yksikön osina, % |
|
|
Liuoksen tiheys |
|
|
Liuoksen tilavuus, cm 3, l, m 3 |
|
|
Molaarinen pitoisuus, mol/l |
|
|
Elektrolyytin dissosiaatioaste (X), yksikön murto-osina tai % |
|
|
Veden ioninen tuote |
K(H2O) = |
|
PH arvo |
pH = -lg |
Pääasiallinen:
Kuznetsova N.E. jne. Kemia. 8. luokka - 10. luokka - M.: Ventana-Graf, 2005-2007.
Kuznetsova N.E., Litvinova T.N., Levkin A.N. Kemia. 11. luokka 2 osassa, 2005-2007.
Egorov A.S. Kemia. Uusi oppikirja korkea-asteen koulutukseen valmistautumiseen. Rostov n/d: Phoenix, 2004.– 640 s.
Egorov A.S. Kemia: moderni kurssi yhtenäiseen valtionkokeeseen valmistautumiseen. Rostov n/a: Phoenix, 2011. (2012) – 699 s.
Egorov A.S. Itseohjautuva käsikirja kemiallisten ongelmien ratkaisemiseen. – Rostov-on-Don: Phoenix, 2000. – 352 s.
Kemia/tutor-opas yliopistoihin hakijoille. Rostov-n/D, Phoenix, 2005–536 s.
Khomchenko G.P., Khomchenko I.G.. Ongelmia kemiassa yliopistoihin hakijoille. M.: Korkeakoulu. 2007.–302s.
Lisätiedot:
Vrublevsky A.I.. Koulutus- ja koulutusmateriaalit kemian keskitettyyn testaukseen valmistautumiseen / A.I. Vrublevsky – Mn.: Unipress LLC, 2004. – 368 s.
Vrublevsky A.I.. 1000 kemian tehtävää muunnosketjuilla ja kontrollitesteillä koululaisille ja hakijoille – Mn.: Unipress LLC, 2003. – 400 s.
Egorov A.S.. Kaiken tyyppiset kemian laskentatehtävät yhtenäiseen valtionkokeeseen valmistautumiseen – Rostov n/D: Phoenix, 2003. – 320 s.
Egorov A.S., Aminova G.Kh.. Tyypillisiä tehtäviä ja harjoituksia kemian tenttiin valmistautumiseen. – Rostov n/d: Phoenix, 2005. – 448 s.
Unified State Exam 2007. Kemia. Opetus- ja koulutusmateriaalit opiskelijoiden valmentamiseen / FIPI - M.: Intellect-Center, 2007. – 272 s.
Yhtenäinen valtionkoe 2011. Kemia. Koulutus- ja koulutuspaketti toim. A.A. Kaverina – M.: Kansankasvatus, 2011.
Ainoat todelliset vaihtoehdot tehtäville valmistautua yhtenäiseen valtionkokeeseen. Yhtenäinen valtionkoe 2007. Kemia/V.Yu. Mishina, E.N. Strelnikova. M.: Federal Testing Center, 2007.–151 s.
Kaverina A.A. Optimaalinen tehtäväpankki opiskelijoiden valmentamiseen. Unified State Exam 2012. Kemia. Oppikirja./ A.A. Kaverina, D.Yu. Dobrotin, Yu.N. Medvedev, M.G. Snastina – M.: Intellect-Center, 2012. – 256 s.
Litvinova T.N., Vyskubova N.K., Azhipa L.T., Solovjova M.V.. Testitehtävät kokeiden lisäksi 10 kuukauden kirjeenvaihtovalmentavien kurssien opiskelijoille (metodologiset ohjeet). Krasnodar, 2004. – s. 18–70.
Litvinova T.N.. Kemia. Yhtenäinen valtionkoe 2011. Harjoittelutestit. Rostov n/d: Phoenix, 2011.– 349 s.
Litvinova T.N.. Kemia. Kokeet yhtenäistä valtionkoetta varten. Rostov n/d.: Phoenix, 2012. - 284 s.
Litvinova T.N.. Kemia. Lait, alkuaineiden ja niiden yhdisteiden ominaisuudet. Rostov n/d.: Phoenix, 2012. - 156 s.
Litvinova T.N., Melnikova E.D., Solovjova M.V.., Azhipa L.T., Vyskubova N.K. Kemia yliopistoihin hakijoiden tehtävissä – M.: Onyx Publishing House LLC: Mir and Education Publishing House LLC, 2009. – 832 s.
Kemian koulutus- ja metodologinen kompleksi lääketieteen ja biologian opiskelijoille, toim. T.N. Litvinova – Krasnodar.: KSMU, – 2008.
Kemia. Yhtenäinen valtionkoe 2008. Pääsykokeet, opetusvälineet / toim. V.N. Doronkina. – Rostov n/d: Legion, 2008.– 271 s.
Luettelo kemian sivustoista:
1. Alhimik. http:// www. alhimik. ru
2. Kemia kaikille. Sähköinen hakuteos täydelliselle kemian kurssille.
http:// www. informika. ru/ teksti/ tietokanta/ kemia/ ALKAA. html
3. Koulukemia - hakuteos. http:// www. koulukemiaa. kirjoittaja. ru
4. Kemian ohjaaja. http://www. chemistry.nm.ru
Internet-resurssit
Alhimik. http:// www. alhimik. ru
Kemia kaikille. Sähköinen hakuteos täydelliselle kemian kurssille.
http:// www. informika. ru/ teksti/ tietokanta/ kemia/ ALKAA. html
Koulukemia - hakuteos. http:// www. koulukemiaa. kirjoittaja. ru
http://www.classchem.narod.ru
Kemian ohjaaja. http://www.
chemistry.nm.ru http://www.alleng.ru/edu/chem.htm
- kemian koulutusmateriaalit Internetissä http://schoolchemistry.by.ru/
- koulun kemia. Tällä sivustolla on mahdollisuus suorittaa online-testejä eri aiheista sekä yhtenäisen valtionkokeen demoversioita http:// www. Kemia ja elämä – XXI vuosisata: populaaritieteellinen aikakauslehti.. ru
hij
Kokoelma peruskaavoja koulun kemian kurssille
Kokoelma peruskaavoja koulun kemian kurssille
G.P. Loginova
Elena Savinkina
E. V. Savinkina G. P. Loginova
Kokoelma kemian peruskaavoja
Opiskelijan taskuopas
yleinen kemia
Tärkeimmät kemialliset käsitteet ja lait Kemiallinen alkuaine
- tämä on tietyntyyppinen atomi, jolla on sama ydinvaraus. Suhteellinen atomimassa
(A r) näyttää kuinka monta kertaa tietyn kemiallisen alkuaineen atomin massa on suurempi kuin hiili-12-atomin massa (12 C). Kemiallinen aine
– kokoelma kemiallisia hiukkasia.
Kemialliset hiukkaset Kaavan yksikkö– tavanomainen hiukkanen, jonka koostumus vastaa annettua kemiallista kaavaa, esimerkiksi:
Ar – argonaine (koostuu Ar-atomeista),
H 2 O – aine vesi (koostuu H 2 O -molekyyleistä),
KNO 3 – kaliumnitraattiaine (koostuu K + -kationeista ja NO 3 ¯ -anioneista).
Fysikaalisten suureiden väliset suhteet Alkuaineen atomimassa (suhteellinen).B, A r (B): Missä*T
(atomi B) – alkuaineen B atomin massa;*t ja
– atomimassayksikkö; 1/12 *t ja = T
(12 C-atomia) = 1,6610 24 g. Aineen määrä
B, A r (B): B, n(B), mol: HUOM)
– hiukkasten lukumäärä B; N A – Avogadron vakio(NA =
6,0210 23 mol -1). Aineen moolimassa
B, A r (B): V, M(V), g/mol: TV)
- massa B. Kaasun molaarinen tilavuus SISÄÄN, V M
B, A r (B): l/mol: V M = 22,4 l/mol (seuraus Avogadron laista), normaaleissa olosuhteissa (n.s. - ilmanpaine p = 101 325 Pa (1 atm); termodynaaminen lämpötila T = 273,15 K tai Celsius-lämpötila t =
0 °C). B vedylle, D
(kaasu B, H 2):* Kaasumaisen aineen tiheys SISÄÄN lentäen, D (kaasu B ilman yli): Alkuaineen massaosa E aineessaV, w(E):
Missä x on E-atomien lukumäärä aineen B kaavassa
Atomin rakenne ja jaksollinen laki D.I. Mendelejev
Massaluku (A) – protonien ja neutronien kokonaismäärä atomiytimessä:
A = N(p 0) + N(p+). Atomin ydinvaraus (Z)yhtä suuri kuin protonien lukumäärä ytimessä ja elektronien lukumäärä atomissa:
Z = N(p+) = N(e¯). Isotoopit – saman alkuaineen atomit, jotka eroavat ytimessä olevien neutronien lukumäärältä, esimerkiksi: kalium-39: 39 K (19 20p + , 19n 0, e¯ ); kalium-40: 40 K (19 21p + , p+,19e¯).
* Energiatasot ja alatasot(AO) kuvaa sitä avaruuden aluetta, jossa todennäköisyys sille, että elektroni, jolla on tietty energia, sijaitsee, on suurin.*S- ja p-orbitaalien muodot
Jaksollinen laki ja jaksollinen järjestelmä D.I. Mendelejev
Alkuaineiden ja niiden yhdisteiden ominaisuudet toistuvat ajoittain kasvavalla atomiluvulla, joka on yhtä suuri kuin alkuaineen atomin ytimen varaus.Jakson numero vastaa elektroneilla täytettyjen energiatasojen lukumäärä, ja tarkoittaa viimeinen täytettävä energiataso(EU).
Ryhmän numero A näyttää Ja jne.
Ryhmän numero B näyttää valenssielektronien lukumäärä ns Ja (n - 1)d.
S-elementit osa– energian alataso (ESL) on täynnä elektroneja ns-EPU– IA- ja IIA-ryhmät, H ja He.
P-elementit osa- täynnä elektroneja np-EPU– IIIA-VIIIA-ryhmät.
D-elementit osa- täynnä elektroneja (P- 1) d-EPU – IB-VIIIB2-ryhmät.
f-elementtien osa- täynnä elektroneja (P-2) f-EPU – lantanidit ja aktinidit.
Muutokset jaksollisen järjestelmän 3. jakson alkuaineiden vetyyhdisteiden koostumuksessa ja ominaisuuksissa
Haihtumaton, hajoaa veden kanssa: NaH, MgH 2, AlH 3.Haihtuvat: SiH 4, PH 3, H2S, HCl.
Muutokset jaksollisen järjestelmän 3. jakson alkuaineiden korkeampien oksidien ja hydroksidien koostumuksessa ja ominaisuuksissa
Perus: Na 2 O – NaOH, MgO – Mg(OH) 2.Amfoteerinen: Al 2 O 3 – Al(OH) 3.
Hapan: SiO 2 – H 4 SiO 4, P 2 O 5 – H 3 PO 4, SO 3 – H 2 SO 4, Cl 2 O 7 – HClO 4.
Kemiallinen sidos
Elektronegatiivisuus(χ) on suure, joka kuvaa molekyylin atomin kykyä hankkia negatiivinen varaus.Kovalenttisen sidoksen muodostumismekanismit
Vaihtomekanismi- kahden vierekkäisten atomien kiertoradan päällekkäisyys, joista jokaisessa oli yksi elektroni.Luovuttaja-akseptorimekanismi– yhden atomin vapaan orbitaalin päällekkäisyys toisen elektroniparin sisältävän atomin kiertoradan kanssa.
Orbitaalien päällekkäisyys sidoksen muodostumisen aikana
* Hybridisaatiotyyppi – hiukkasen geometrinen muoto – sidosten välinen kulma
Keskusatomin orbitaalien hybridisaatio– niiden energian ja muodon kohdistaminen.sp– lineaarinen – 180°
sp 2– kolmiomainen – 120°
sp 3– tetraedrinen – 109,5°
sp 3 d– trigonaali-bipyramidaalinen – 90°; 120°
sp 3 d 2– oktaedri – 90°
Seokset ja liuokset
Ratkaisu- homogeeninen järjestelmä, joka koostuu kahdesta tai useammasta aineesta, jonka pitoisuutta voidaan vaihdella tietyissä rajoissa.
Ratkaisu: liuotin (esim. vesi) + liuennut aine.
Oikeita ratkaisuja sisältävät alle 1 nanometrin hiukkasia.
Kolloidiset liuokset Ne sisältävät hiukkasia, joiden koko vaihtelee 1-100 nanometrin välillä.
Mekaaniset seokset(suspensiot) sisältävät hiukkasia, jotka ovat suurempia kuin 100 nanometriä.
Jousitus=> kiinteä + neste
Emulsio=> neste + neste
Vaahtoa, sumua=> kaasu + neste
Heterogeeniset seokset erotetaan laskeutus ja suodatus.
Homogeeniset seokset erotetaan haihdutus, tislaus, kromatografia.
Kyllästetty liuos on tai voi olla tasapainossa liuenneen aineen kanssa (jos liuennut aine on kiinteä, sen ylimäärä on sakassa).
Liukoisuus– liuenneen aineen pitoisuus kyllästetyssä liuoksessa tietyssä lämpötilassa.
Tyydyttymätön liuos Vähemmän,
Ylikyllästetty liuos sisältää liuennutta ainetta lisää, kuin sen liukoisuus tietyssä lämpötilassa.
Fysikaalis-kemiallisten suureiden väliset suhteet liuoksessa
Liuenneen aineen massaosa Kaasun molaarinen tilavuus w(B); yksikön murto-osa tai %:B, A r (B): V, M(V), g/mol:- massa B,
t(r)- liuoksen massa.
liuoksen paino, m(p), g:
m(p) = m(B) + m(H20) = V(p) ρ(p),
jossa F(p) on liuoksen tilavuus;ρ(p) – liuoksen tiheys.
Liuoksen tilavuus, V(p), l:
Molaarinen keskittyminen, s(V), mol/l:missä n(B) on aineen B määrä;
M(B) – aineen B moolimassa.
Liuoksen koostumuksen muuttaminen
Liuoksen laimentaminen vedellä:> TV)= t(B);
> liuoksen massa kasvaa lisätyn veden massalla: m"(p) = m(p) + m(H20).
Veden haihduttaminen liuoksesta:
> liuenneen aineen massa ei muutu: t"(B) = t(B).
> liuoksen massa pienenee haihtuneen veden massalla: m"(p) = m(p) - m(H20).
Kahden ratkaisun yhdistäminen: Liuosmassat sekä liuenneen aineen massat laskevat yhteen:
t"(B) = t(B) + t"(B);
t"(p) = t(p) + t"(p).
Kristallipisara: liuenneen aineen massaa ja liuoksen massaa vähennetään saostuneiden kiteiden massalla:
m"(B) = m(B) - m(sedimentti); m"(p) = m(p) - m(sedimentti).
Veden massa ei muutu.
Kemiallisen reaktion lämpövaikutus
*Aineen muodostumisen entalpia ΔH°(B), kJ/mol, on reaktion entalpia, jossa muodostuu 1 mooli ainetta yksinkertaisista aineista niiden standarditilassa eli vakiopaineessa (1 atm kutakin järjestelmän kaasua kohden tai yhteensä paine 1 atm ilman kaasumaisen reaktion osallistujia) ja vakiolämpötila (yleensä 298 K , tai 25 °C).*Kemiallisen reaktion lämpövaikutus (Hessin laki)
Q = ΣQ(Tuotteet) - ΣQ(reagenssit).
ΔН° = ΣΔН°(tuotteet) – Σ ΔН°(reagenssit).
Reaktiota varten aA + bB +… = dD + eE +…ΔH° = (dΔH°(D) + eΔH°(E) +…) – (aΔH°(A) + bΔH°(B) +…),
Missä a, b, d, e– stoikiometriset aineiden määrät, jotka vastaavat reaktioyhtälön kertoimia.Kemiallinen reaktionopeus
Jos ajan kuluessa τ tilavuudessa V reagoivan aineen tai tuotteen määrä, joka on muuttunut Δ:llä n, nopeus reaktio:
Monomolekyylireaktiolle A → …:
v = k c(A).
Bimolekulaariselle reaktiolle A + B → ...:v = k c(A) c(B).
Trimolekulaariselle reaktiolle A + B + C → ...:v = k c(A) c(B) c(C).
Kemiallisen reaktion nopeuden muuttaminen
Nopeusreaktio lisääntyä:1) kemiallisesti aktiivinen reagenssit;
2) edistäminen reagenssipitoisuudet;
3) lisääntyä
4) edistäminen lämpötila;
5) katalyytit. Nopeusreaktio vähentää:
1) kemiallisesti epäaktiivinen reagenssit;
2) alentaminen reagenssipitoisuudet;
3) vähentää kiinteiden ja nestemäisten reagenssien pinnat;
4) alentaminen lämpötila;
5) estäjät.
*Lämpötilanopeuskerroin(γ) on yhtä suuri kuin luku, joka osoittaa kuinka monta kertaa reaktionopeus kasvaa lämpötilan noustessa kymmenen astetta:
Kemiallinen tasapaino
*Kemiallisen tasapainon massan vaikutuksen laki: tasapainotilassa tuotteiden molaaristen pitoisuuksien tulon suhde potenssiin, joka on yhtä suuri kuin
Niiden stökiömetriset kertoimet lähtöaineiden molaaristen pitoisuuksien tulona tehoissa, jotka ovat yhtä suuria kuin niiden stökiömetriset kertoimet, vakiolämpötilassa on vakioarvo (pitoisuuden tasapainovakio).
Kemiallisen tasapainon tilassa palautuvassa reaktiossa:
aA + bB + … ↔ dD + fF + …
K c = [D] d [F] f .../ [A] a [B] b ...
*Kemiallisen tasapainon siirtyminen kohti tuotteiden muodostumista
1) Reagenssien pitoisuuden lisääminen;2) tuotteiden pitoisuuden vähentäminen;
3) lämpötilan nousu (endoterminen reaktio);
4) lämpötilan lasku (eksotermiseen reaktioon);
5) paineen nousu (reaktiolle, joka tapahtuu tilavuuden pienentyessä);
6) paineen lasku (reaktiolle, joka tapahtuu tilavuuden kasvaessa).
Vaihda reaktiot liuoksessa
Elektrolyyttinen dissosiaatio– ionien (kationien ja anionien) muodostumisprosessi, kun tietyt aineet liukenevat veteen.
hapot muodostuvat vetykationit Ja happamat anionit, Esimerkiksi:
HN03 = H+ + NO3¯
Elektrolyyttisen dissosiaation aikana syyt muodostuvat metallikationit ja hydroksidi-ionit, esimerkiksi:NaOH = Na + + OH¯
Elektrolyyttisen dissosiaation aikana suolat(medium, double, mix) muodostuvat metallikationit ja happamia anioneja, esimerkiksi:NaNO 3 = Na + + NO 3¯
KAl(SO 4) 2 = K + + Al 3+ + 2SO 4 2-
Elektrolyyttisen dissosiaation aikana happamat suolat muodostuvat metallikationit ja happamat hydroanionit, esimerkiksi:NaHCO 3 = Na + + HCO 3 ‾
Joitakin vahvoja happoja
HBr, HCl, HClO 4, H 2 Cr 2 O 7, HI, HMnO 4, H 2 SO 4, H 2 SeO 4, HNO 3, H 2 CrO 4Muutamia vahvoja syitä
RbOH, CsOH, KOH, NaOH, LiOH, Ba(OH)2, Sr(OH)2, Ca(OH)2Dissosiaatioaste α– dissosioituneiden hiukkasten lukumäärän suhde alkuhiukkasten lukumäärään.
Vakiolla äänenvoimakkuudella:
Aineiden luokitus dissosiaatioasteen mukaan
Bertholletin sääntö
Vaihtoreaktiot liuoksessa etenevät peruuttamattomasti, jos seurauksena on sakan, kaasun tai heikon elektrolyytin muodostuminen.Esimerkkejä molekyyli- ja ionireaktioyhtälöistä
1. Molekyyliyhtälö: CuCl 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaCl"Täydellinen" ioniyhtälö: Сu 2+ + 2Сl¯ + 2Na + + 2OH¯ = Cu(OH) 2 ↓ + 2Na + + 2Сl¯
"Lyhyt" ioniyhtälö: Cu 2+ + 2OH¯ = Cu(OH) 2 ↓
2. Molekyyliyhtälö: FeS (T) + 2HCl = FeCl 2 + H 2 S
"Täydellinen" ioniyhtälö: FeS + 2H + + 2Сl¯ = Fe 2+ + 2Сl¯ + H 2 S
"Lyhyt" ioniyhtälö: FeS (T) + 2H + = Fe 2+ + H 2 S
3. Molekyyliyhtälö: 3HNO 3 + K 3 PO 4 = H 3 PO 4 + 3KNO 3
"Täydellinen" ioniyhtälö: 3H + + 3NO 3 ¯ + 3K + + PO 4 3- = H 3 PO 4 + 3K + + 3NO 3 ¯
"Lyhyt" ioniyhtälö: 3H + + PO 4 3- = H 3 PO 4
* Vetyarvo
(pH) pH = – log = 14 + log* pH-alue laimeille vesiliuoksille
pH 7 (neutraali ympäristö)Esimerkkejä vaihtoreaktioista
Neutralisaatioreaktio- vaihtoreaktio, joka tapahtuu hapon ja emäksen vuorovaikutuksessa.1. Alkali + vahva happo: Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Ba 2+ + 2ON¯ + 2H + + 2Сl¯ = Ba 2+ + 2Сl¯ + 2Н 2 O
H + + OH¯ = H2O
2. Vähäliukoinen emäs + vahva happo: Cu(OH) 2(t) + 2HCl = CuCl 2 + 2H 2 O
Cu(OH)2 + 2H + + 2Cl¯ = Cu 2+ + 2Cl¯ + 2H 2O
Cu(OH)2 + 2H+ = Cu2+ + 2H20
*Hydrolyysi– aineen ja veden välinen vaihtoreaktio muuttamatta atomien hapetusastetta.
1. Binääriyhdisteiden palautumaton hydrolyysi:
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
2. Suolojen palautuva hydrolyysi:
A) Muodostuu suolaa vahva emäskationi ja vahva happoanioni:
NaCl = Na + + Сl¯
Na + + H20 ≠ ;
Cl¯ + H20 ≠
Ei ole hydrolyysiä; neutraali ympäristö, pH = 7.
B) Muodostuu suolaa vahva emäskationi ja heikko happoanioni:
Na 2S = 2Na + + S 2-
Na + + H20 ≠
S 2- + H 2O ↔ HS¯ + OH¯
Hydrolyysi anionilla; emäksinen ympäristö, pH >7.
B) Muodostuu suolaa heikon tai niukkaliukoisen emäksen kationi ja vahvan hapon anioni:
Johdantokappaleen loppu.
Tekstin tarjoaa liters LLC.
Voit maksaa kirjan turvallisesti Visa-, MasterCard-, Maestro-pankkikortilla, matkapuhelintililtä, maksupäätteestä, MTS- tai Svyaznoy-kaupassa, PayPalin, WebMoneyn, Yandex.Moneyn, QIWI Walletin, bonuskorttien tai toinen sinulle sopiva tapa.
Tarkista tiedot. On tarpeen tarkistaa tässä artikkelissa esitettyjen tosiasioiden tarkkuus ja luotettavuus. Keskustelusivulla käydään keskustelua aiheesta: Epäilykset terminologiasta. Kemiallinen kaava ... Wikipedia
Kemiallinen kaava heijastaa tietoa aineiden koostumuksesta ja rakenteesta käyttämällä kemiallisia symboleja, numeroita ja hakasulkeiden jakomerkkejä. Tällä hetkellä erotellaan seuraavan tyyppisiä kemiallisia kaavoja: Yksinkertaisin kaava. Voidaan hankkia kokeneesta... ... Wikipediasta
Kemiallinen kaava heijastaa tietoa aineiden koostumuksesta ja rakenteesta käyttämällä kemiallisia symboleja, numeroita ja hakasulkeiden jakomerkkejä. Tällä hetkellä erotellaan seuraavan tyyppisiä kemiallisia kaavoja: Yksinkertaisin kaava. Voidaan hankkia kokeneesta... ... Wikipediasta
Kemiallinen kaava heijastaa tietoa aineiden koostumuksesta ja rakenteesta käyttämällä kemiallisia symboleja, numeroita ja hakasulkeiden jakomerkkejä. Tällä hetkellä erotellaan seuraavan tyyppisiä kemiallisia kaavoja: Yksinkertaisin kaava. Voidaan hankkia kokeneesta... ... Wikipediasta
Kemiallinen kaava heijastaa tietoa aineiden koostumuksesta ja rakenteesta käyttämällä kemiallisia symboleja, numeroita ja hakasulkeiden jakomerkkejä. Tällä hetkellä erotellaan seuraavan tyyppisiä kemiallisia kaavoja: Yksinkertaisin kaava. Voidaan hankkia kokeneesta... ... Wikipediasta
Pääartikkeli: Epäorgaaniset yhdisteet Luettelo epäorgaanisista yhdisteistä alkuaineittain tietoluettelo epäorgaanisista yhdisteistä aakkosjärjestyksessä (kaavan mukaan) kunkin aineen osalta, alkuaineiden vetyhapot (jos ... ... Wikipedia
Tämä artikkeli tai osio kaipaa tarkistusta. Paranna artikkelia artikkeleiden kirjoittamissääntöjen mukaisesti... Wikipedia
Kemiallinen yhtälö (kemiallisen reaktion yhtälö) on kemiallisen reaktion tavanomainen esitys kemiallisten kaavojen, numeeristen kertoimien ja matemaattisten symbolien avulla. Kemiallisen reaktion yhtälö antaa laadullisen ja kvantitatiivisen... ... Wikipedian
Kemialliset ohjelmistot ovat tietokoneohjelmia, joita käytetään kemian alalla. Sisältö 1 Kemialliset toimittajat 2 Alustat 3 Kirjallisuus ... Wikipedia
Kirjat
- Japani-englanti-venäläinen sanakirja teollisuuslaitteiden asennukseen. Noin 8000 termiä, Popova I.S. Sanakirja on tarkoitettu laajalle käyttäjäjoukolle ja ensisijaisesti kääntäjille ja teknisille asiantuntijoille, jotka osallistuvat teollisuuslaitteiden toimittamiseen ja käyttöönottoon Japanista tai...
- Lyhyt biokemiallisten termien sanakirja, Kunizhev S.M.. Sanakirja on tarkoitettu yliopistojen kemian ja biologian erikoisalojen opiskelijoille, jotka opiskelevat yleisen biokemian, ekologian ja biotekniikan perusteiden kurssia, ja sitä voidaan käyttää myös ...
useita peruskäsitteitä ja kaavoja.
Kaikilla aineilla on erilainen massa, tiheys ja tilavuus. Yhden elementin metallipala voi painaa monta kertaa enemmän kuin täsmälleen samankokoinen kappale toista metallia.
Mooli(moolien määrä)
nimitys: mooli, kansainvälinen: mol- aineen määrän mittayksikkö. Vastaa aineen määrää, joka sisältää N.A. hiukkaset (molekyylit, atomit, ionit) Siksi otettiin käyttöön universaali määrä - myyrien määrä. Tehtävissä usein tavattu lause on "vastaanotettu... ainemooli"
N.A.= 6,02 1023
N.A.- Avogadron numero. Myös "numero sopimuksen mukaan". Kuinka monta atomia kynän kärjessä on? Noin tuhat. Ei ole kätevää toimia sellaisilla määrillä. Siksi kemistit ja fyysikot ympäri maailmaa olivat yhtä mieltä - nimetään 6,02 × 1023 hiukkasta (atomeja, molekyylejä, ioneja) 1 mooli aineet.
1 mooli = 6,02 1023 hiukkasta
Tämä oli ensimmäinen peruskaavoista ongelmien ratkaisemiseksi.
6,0210 23 mol -1).
Moolimassa aine on yhden massa aineen mooli.
Merkitty Mr. Se löytyy jaksollisen taulukon mukaan - se on yksinkertaisesti aineen atomimassojen summa.
Esimerkiksi meille annetaan rikkihappoa - H2SO4. Lasketaan aineen moolimassa: atomimassa H = 1, S-32, O-16.
Mr(H2SO4)=1 2+32+16 4=98 g/mol.
Toinen välttämätön kaava ongelmien ratkaisemiseksi on
aineen massakaava:
Toisin sanoen aineen massan löytämiseksi sinun on tiedettävä moolien lukumäärä (n), ja löydämme moolimassan jaksollisesta taulukosta.
Massan säilymislaki - Kemialliseen reaktioon joutuvien aineiden massa on aina yhtä suuri kuin tuloksena olevien aineiden massa.
Jos tiedämme reagoineiden aineiden massa(t), voimme löytää reaktion tuotteiden massa(t). Ja päinvastoin.
Kolmas kaava kemiallisten ongelmien ratkaisemiseksi on
aineen tilavuus:
Tämä kuva ei valitettavasti noudata ohjeitamme. Jos haluat jatkaa julkaisua, poista kuva tai lataa uusi.Mistä numero 22.4 tulee? From Avogadron laki:
sama määrä eri kaasuja samassa lämpötilassa ja paineessa sisältää saman määrän molekyylejä.
Avogadron lain mukaan 1 moolilla ihanteellista kaasua normaaleissa olosuhteissa (n.s.) on sama tilavuus Vm= 22.413 996(39) l
Eli jos ongelmassa annetaan normaalit olosuhteet, niin moolien lukumäärän (n) tiedossa voimme löytää aineen tilavuuden.
Niin, peruskaavat ongelmien ratkaisemiseksi kemiassa
Avogadron numeroN.A.
6,02 1023 hiukkasta
(12 C-atomia) = 1,6610 24 g. n (mol)
n = V\22,4 (l\mol)
Aineen massa m (g)
Aineen tilavuus V(l)
V=n 22,4 (l\mol)
Tämä kuva ei valitettavasti noudata ohjeitamme. Jos haluat jatkaa julkaisua, poista kuva tai lataa uusi.Nämä ovat kaavoja. Usein ongelmien ratkaisemiseksi sinun on ensin kirjoitettava reaktioyhtälö ja (pakollinen!) Järjestä kertoimet - niiden suhde määrittää moolisuhteen prosessissa.
Avainsanat: Kemia 8. luokka. Kaikki kaavat ja määritelmät, fysikaalisten suureiden symbolit, mittayksiköt, etuliitteet mittayksiköiden merkitsemiseen, yksiköiden väliset suhteet, kemialliset kaavat, perusmääritelmät, lyhyesti, taulukot, kaaviot.
1. Symbolit, nimet ja mittayksiköt
joitain kemiassa käytettyjä fysikaalisia määriä
| Fyysinen määrä | Nimitys | Yksikkö |
| Aika | t | Kanssa |
| Paine | s | Pa, kPa |
| (12 C-atomia) = 1,6610 24 g. | ν | mooli |
| Aineen massa | m | kg, g |
| Valtaosa | ω | Mitattomat |
| Moolimassa | M | kg/mol, g/mol |
| Molaarinen tilavuus | Vn | m3/mol, l/mol |
| Aineen määrä | V | m 3, l |
| Tilavuusosuus | Mitattomat | |
| - tämä on tietyntyyppinen atomi, jolla on sama ydinvaraus. | A r | Mitattomat |
| Herra | Mitattomat | |
| Kaasun A suhteellinen tiheys kaasuun B | D B (A) | Mitattomat |
| Aineen tiheys | R | kg/m3, g/cm3, g/ml |
| Avogadron vakio | N A | 1/mol |
| Absoluuttinen lämpötila | T | K (Kelvin) |
| Lämpötila celsiusasteina | t | °C (celsiusastetta) |
| Kemiallisen reaktion lämpövaikutus | K | kJ/mol |

2. Fysikaalisten suureiden yksiköiden väliset suhteet

3. Kemialliset kaavat 8. luokalla
4. Perusmääritelmät 8. luokalla

- Atomi- aineen pienin kemiallisesti jakamaton hiukkanen.
- Tärkeimmät kemialliset käsitteet ja lait- tietyntyyppinen atomi.
- Molekyyli- aineen pienin hiukkanen, joka säilyttää koostumuksensa ja kemialliset ominaisuutensa ja koostuu atomeista.
- Yksinkertaiset aineet- aineet, joiden molekyylit koostuvat samantyyppisistä atomeista.
- Monimutkaiset aineet- aineet, joiden molekyylit koostuvat erityyppisistä atomeista.
- Aineen laadullinen koostumus näyttää mistä alkuaineiden atomeista se koostuu.
- Aineen määrällinen koostumus näyttää kunkin elementin atomien lukumäärän koostumuksessaan.
- Kemiallinen kaava- aineen laadullisen ja määrällisen koostumuksen tavanomainen kirjaaminen kemiallisia symboleja ja indeksejä käyttäen.
- Atomimassayksikkö(amu) - atomimassan mittayksikkö, joka vastaa 1/12 hiiliatomin massaa 12 C.
- Mooli- aineen määrä, joka sisältää hiukkasten lukumäärän, joka vastaa atomien lukumäärää 0,012 kg:ssa hiiltä 12 C.
- Avogadron vakio (Na = 6*10 23 mol -1) - yhden moolin sisältämien hiukkasten lukumäärä.
- 6,0210 23 mol -1). (M ) on aineen massa, joka on otettu 1 moolilla.
- - tämä on tietyntyyppinen atomi, jolla on sama ydinvaraus. elementti A r - tietyn alkuaineen atomin massan m 0 suhde 1/12 hiiliatomin massasta 12 C.
- Suhteellinen molekyylipaino aineet M r - tietyn aineen molekyylin massan suhde 1/12 hiiliatomin massasta 12 C. Suhteellinen molekyylimassa on yhtä suuri kuin yhdisteen muodostavien kemiallisten alkuaineiden suhteellisten atomimassojen summa. ottaa huomioon tietyn alkuaineen atomien lukumäärä.
- Valtaosa kemiallinen alkuaine ω(X) osoittaa, minkä osan aineen X suhteellisesta molekyylimassasta vastaa tietty alkuaine.
ATOMI-MOLEKULAARINEN OPETUS
1. On aineita, joilla on molekyylirakenne ja ei-molekyylirakenne.
2. Molekyylien välillä on rakoja, joiden koot riippuvat aineen aggregaatiotilasta ja lämpötilasta.
3. Molekyylit ovat jatkuvassa liikkeessä.
4. Molekyylit koostuvat atomeista.
6. Atomeille on ominaista tietty massa ja koko.
Fysikaalisten ilmiöiden aikana molekyylit säilyvät kemiallisten ilmiöiden aikana, yleensä ne tuhoutuvat. Kemiallisten ilmiöiden aikana atomit järjestäytyvät uudelleen muodostaen molekyylejä uusista aineista.

AINEEN VAKION KOOSTUMUKSEN LAKI
Jokaisella kemiallisesti puhtaalla molekyylirakenteen aineella on valmistusmenetelmästä riippumatta jatkuva laadullinen ja määrällinen koostumus.
VALENSSI
Valenssi on kemiallisen alkuaineen atomin ominaisuus kiinnittää tai korvata tietty määrä toisen alkuaineen atomeja.

KEMIALLINEN REAKTIO
Kemiallinen reaktio on ilmiö, jonka seurauksena yhdestä aineesta muodostuu muita aineita. Reagenssit ovat aineita, jotka joutuvat kemialliseen reaktioon. Reaktiotuotteet ovat aineita, jotka muodostuvat reaktion seurauksena.
Kemiallisten reaktioiden merkit:
1. Lämmön (valo) vapautuminen.
2. Muuta väriä.
3. Haju tulee näkyviin.
4. Sedimentin muodostuminen.
5. Kaasun vapautus.




 V m= 22,4 l/mol (n.s.)
V m= 22,4 l/mol (n.s.)