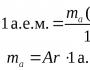रसायन शास्त्र में सूत्रों का संग्रह. समस्याओं को हल करने के लिए बुनियादी सूत्र
|
परिमाण और उसका आयाम |
अनुपात |
|
तत्व X का परमाणु द्रव्यमान (सापेक्ष) |
|
|
तत्व क्रमांक |
जेड= एन(इ –) = एन(आर +) |
|
पदार्थ X में तत्व E का द्रव्यमान अंश, एक इकाई के अंशों में, % में |
|
|
पदार्थ X की मात्रा, mol | |
|
गैस पदार्थ की मात्रा, मोल |
कुंआ। – आर= 101 325 पा, टी= 273 कि |
|
पदार्थ X का मोलर द्रव्यमान, g/mol, kg/mol |
|
|
पदार्थ का द्रव्यमान X, g, kg |
एम(एक्स)= एन(एक्स) एम(एक्स) |
|
गैस का मोलर आयतन, l/mol, m 3/mol |
वी एम= 22.4 एल/मोल एन.एस. पर। |
|
गैस की मात्रा, एम3 |
वी = वी एम × एन |
|
उत्पाद उपज |
|
|
पदार्थ X का घनत्व, g/l, g/ml, kg/m3 |
|
|
हाइड्रोजन द्वारा गैसीय पदार्थ X का घनत्व |
|
|
हवा में गैसीय पदार्थ X का घनत्व |
एम(वायु) = 29 ग्राम/मोल |
|
यूनाइटेड गैस कानून |
|
|
मेंडेलीव-क्लैपेरॉन समीकरण |
पीवी = एनआरटी, आर= 8.314 जे/मोल×के |
|
गैसों के मिश्रण में किसी गैसीय पदार्थ का आयतन अंश, एक इकाई के अंशों में या % में |
|
|
गैसों के मिश्रण का दाढ़ द्रव्यमान |
|
|
मिश्रण में किसी पदार्थ (X) का मोल अंश |
|
|
ऊष्मा की मात्रा, जे, केजे |
क्यू = एन(एक्स) क्यू(एक्स) |
|
प्रतिक्रिया का थर्मल प्रभाव |
क्यू =–एच |
|
पदार्थ X, J/mol, kJ/mol के निर्माण की ऊष्मा |
|
|
रासायनिक प्रतिक्रिया दर (mol/lsec) |
|
|
सामूहिक कार्रवाई का कानून (एक साधारण प्रतिक्रिया के लिए) |
एए+ वीबी= साथसी+ डीडी यू = क साथ ए(ए) साथ वी(बी) |
|
वान्ट हॉफ का नियम |
|
|
पदार्थ की घुलनशीलता (X) (g/100 g विलायक) |
|
|
मिश्रण A + X में पदार्थ X का द्रव्यमान अंश, एक इकाई के अंशों में, % में |
|
|
घोल का वजन, जी, किग्रा |
एम(आरआर) = एम(एक्स)+ एम(H2O) एम(आरआर) = वी(आरआर) (आरआर) |
|
घोल में घुले पदार्थ का द्रव्यमान अंश, एक इकाई के अंशों में, % में |
|
|
समाधान घनत्व |
|
|
समाधान की मात्रा, सेमी 3, एल, एम 3 |
|
|
मोलर सांद्रता, मोल/ली |
|
|
इलेक्ट्रोलाइट पृथक्करण की डिग्री (एक्स), एक इकाई या % के अंशों में |
|
|
जल का आयनिक उत्पाद |
क(H2O)= |
|
पीएच मान |
पीएच = -एलजी |
मुख्य:
कुज़नेत्सोवा एन.ई. और आदि. रसायन विज्ञान। 8वीं कक्षा-10वीं कक्षा - एम.: वेंटाना-ग्राफ, 2005-2007।
कुज़नेत्सोवा एन.ई., लिट्विनोवा टी.एन., लेविन ए.एन.रसायन विज्ञान.11वीं कक्षा 2 भागों में, 2005-2007।
ईगोरोव ए.एस.रसायन विज्ञान। विश्वविद्यालयों की तैयारी के लिए नई पाठ्यपुस्तक। रोस्तोव एन/डी: फीनिक्स, 2004.- 640 पी।
ईगोरोव ए.एस. रसायन विज्ञान: एकीकृत राज्य परीक्षा की तैयारी के लिए एक आधुनिक पाठ्यक्रम। रोस्तोव एन/ए: फीनिक्स, 2011. (2012) - 699 पी।
ईगोरोव ए.एस.रासायनिक समस्याओं के समाधान के लिए स्व-निर्देश पुस्तिका। - रोस्तोव-ऑन-डॉन: फीनिक्स, 2000. - 352 पी।
विश्वविद्यालयों के आवेदकों के लिए रसायन विज्ञान/ट्यूटर मैनुअल। रोस्तोव-एन/डी, फीनिक्स, 2005-536 पी।
खोमचेंको जी.पी., खोमचेंको आई.जी.. विश्वविद्यालयों में आवेदकों के लिए रसायन विज्ञान में समस्याएं। एम.: हायर स्कूल. 2007.–302पी.
अतिरिक्त:
व्रुब्लेव्स्की ए.आई.. रसायन विज्ञान/ए.आई. में केंद्रीकृत परीक्षण की तैयारी के लिए शैक्षिक और प्रशिक्षण सामग्री। व्रुब्लेव्स्की-एमएन.: यूनिप्रेस एलएलसी, 2004. - 368 पी।
व्रुब्लेव्स्की ए.आई.. स्कूली बच्चों और आवेदकों के लिए परिवर्तनों और नियंत्रण परीक्षणों की श्रृंखलाओं के साथ रसायन विज्ञान में 1000 समस्याएं - एमएन.: यूनिप्रेस एलएलसी, 2003। - 400 पी।
ईगोरोव ए.एस.. एकीकृत राज्य परीक्षा की तैयारी के लिए रसायन विज्ञान में सभी प्रकार की गणना समस्याएं - रोस्तोव एन/डी: फीनिक्स, 2003। - 320 पी।
ईगोरोव ए.एस., अमीनोवा जी.के.एच.. रसायन विज्ञान परीक्षा की तैयारी के लिए विशिष्ट कार्य और अभ्यास। - रोस्तोव एन/डी: फीनिक्स, 2005। - 448 पी।
एकीकृत राज्य परीक्षा 2007। रसायन विज्ञान। छात्रों को तैयार करने के लिए शैक्षिक और प्रशिक्षण सामग्री / एफआईपीआई - एम.: इंटेलेक्ट-सेंटर, 2007। - 272 पी।
एकीकृत राज्य परीक्षा 2011. रसायन विज्ञान। शैक्षिक एवं प्रशिक्षण किट एड. ए.ए. कावेरिना - एम.: राष्ट्रीय शिक्षा, 2011।
एकीकृत राज्य परीक्षा की तैयारी के लिए कार्यों का एकमात्र वास्तविक विकल्प। एकीकृत राज्य परीक्षा 2007. रसायन विज्ञान/वी.यु. मिशिना, ई.एन. स्ट्रेलनिकोवा। एम.: संघीय परीक्षण केंद्र, 2007.-151 पी.
कावेरिना ए.ए. छात्रों को तैयार करने के लिए कार्यों का इष्टतम बैंक। एकीकृत राज्य परीक्षा 2012। रसायन विज्ञान। पाठ्यपुस्तक./ ए.ए. कावेरिना, डी.यू. डोब्रोटिन, यू.एन. मेदवेदेव, एम.जी. स्नैस्टिना - एम.: इंटेलेक्ट-सेंटर, 2012. - 256 पी।
लिट्विनोवा टी.एन., विस्कुबोवा एन.के., अझिपा एल.टी., सोलोव्योवा एम.वी.. 10 महीने के पत्राचार प्रारंभिक पाठ्यक्रम (पद्धति संबंधी निर्देश) के छात्रों के लिए परीक्षणों के अतिरिक्त परीक्षण कार्य। क्रास्नोडार, 2004. - पी. 18 - 70.
लिट्विनोवा टी.एन.. रसायन विज्ञान। एकीकृत राज्य परीक्षा 2011. प्रशिक्षण परीक्षण. रोस्तोव एन/डी: फीनिक्स, 2011.- 349 पी।
लिट्विनोवा टी.एन.. रसायन विज्ञान। एकीकृत राज्य परीक्षा के लिए परीक्षण। रोस्तोव एन/डी.: फीनिक्स, 2012. - 284 पी।
लिट्विनोवा टी.एन.. रसायन विज्ञान। तत्वों और उनके यौगिकों के नियम, गुण। रोस्तोव एन/डी.: फीनिक्स, 2012. - 156 पी।
लिट्विनोवा टी.एन., मेलनिकोवा ई.डी., सोलोव्योवा एम.वी.., अज़ीपा एल.टी., विस्कुबोवा एन.के.विश्वविद्यालयों में आवेदकों के लिए कार्यों में रसायन शास्त्र - एम.: ओनिक्स पब्लिशिंग हाउस एलएलसी: मीर एंड एजुकेशन पब्लिशिंग हाउस एलएलसी, 2009. - 832 पी।
चिकित्सा और जैविक कक्षाओं के छात्रों के लिए रसायन विज्ञान में शैक्षिक और पद्धतिगत परिसर, एड। टी.एन. लिटविनोवा। - क्रास्नोडार: केएसएमयू, - 2008।
रसायन विज्ञान। एकीकृत राज्य परीक्षा 2008. प्रवेश परीक्षा, शिक्षण सहायता/एड। वी.एन. डोरोनकिना। - रोस्तोव एन/ए: लीजन, 2008.- 271 पी।
रसायन विज्ञान पर वेबसाइटों की सूची:
1. अलहिमिक। एचटीटीपी:// www. अल्हिमिक. आरयू
2. सभी के लिए रसायन विज्ञान। संपूर्ण रसायन विज्ञान पाठ्यक्रम के लिए इलेक्ट्रॉनिक संदर्भ पुस्तक।
एचटीटीपी:// www. Informika. आरयू/ मूलपाठ/ डेटाबेस/ रसायन विज्ञान/ शुरू. एचटीएमएल
3. स्कूल रसायन विज्ञान - संदर्भ पुस्तक। एचटीटीपी:// www. स्कूल रसायन शास्त्र. द्वारा. आरयू
4. रसायन शास्त्र शिक्षक. http://www. chemistry.nm.ru
इंटरनेट संसाधन
अल्हिमिक। एचटीटीपी:// www. अल्हिमिक. आरयू
सभी के लिए रसायन शास्त्र. संपूर्ण रसायन विज्ञान पाठ्यक्रम के लिए इलेक्ट्रॉनिक संदर्भ पुस्तक।
एचटीटीपी:// www. Informika. आरयू/ मूलपाठ/ डेटाबेस/ रसायन विज्ञान/ शुरू. एचटीएमएल
स्कूल रसायन शास्त्र - संदर्भ पुस्तक। एचटीटीपी:// www. स्कूल रसायन शास्त्र. द्वारा. आरयू
http://www.classchem.naroad.ru
रसायन शास्त्र शिक्षक. http://www. chemistry.nm.ru
http://www.alleng.ru/edu/chem.htm- रसायन विज्ञान पर शैक्षिक इंटरनेट संसाधन
http://schoolchemistry.by.ru/- स्कूल रसायन विज्ञान। इस साइट पर विभिन्न विषयों पर ऑन-लाइन परीक्षण के साथ-साथ एकीकृत राज्य परीक्षा के डेमो संस्करण लेने का अवसर है
रसायन विज्ञान और जीवन-XXI सदी: लोकप्रिय विज्ञान पत्रिका। एचटीटीपी:// www. हिज. आरयू
स्कूल रसायन विज्ञान पाठ्यक्रम के लिए बुनियादी सूत्रों का संग्रह
स्कूल रसायन विज्ञान पाठ्यक्रम के लिए बुनियादी सूत्रों का संग्रह
जी. पी. लॉगिनोवा
ऐलेना सविन्किना
ई. वी. सविन्किना जी. पी. लॉगिनोवा
रसायन विज्ञान में बुनियादी सूत्रों का संग्रह
विद्यार्थी की पॉकेट गाइड
सामान्य रसायन शास्त्र
सबसे महत्वपूर्ण रासायनिक अवधारणाएँ और नियम
रासायनिक तत्व- यह समान परमाणु आवेश वाला एक निश्चित प्रकार का परमाणु है।
सापेक्ष परमाणु द्रव्यमान(ए आर) दर्शाता है कि किसी दिए गए रासायनिक तत्व के परमाणु का द्रव्यमान कार्बन-12 परमाणु (12 सी) के द्रव्यमान से कितनी गुना अधिक है।
रासायनिक पदार्थ- किसी भी रासायनिक कणों का संग्रह।
रासायनिक कण
सूत्र इकाई– एक पारंपरिक कण, जिसकी संरचना दिए गए रासायनिक सूत्र से मेल खाती है, उदाहरण के लिए:Ar – आर्गन पदार्थ (Ar परमाणुओं से मिलकर बना है),
एच 2 ओ - पदार्थ पानी (एच 2 ओ अणुओं से मिलकर बनता है),
KNO 3 - पोटेशियम नाइट्रेट पदार्थ (K + धनायन और NO 3 ¯ आयनों से मिलकर बनता है)।
भौतिक राशियों के बीच संबंध
तत्व का परमाणु द्रव्यमान (सापेक्ष)।बी, ए आर (बी):कहाँ *टी(परमाणु बी) - तत्व बी के एक परमाणु का द्रव्यमान;
*टी और- परमाण्विक भार इकाई;
*टी और = 1/12 टी(12 सी परमाणु) = 1.6610 24 ग्राम।
पदार्थ की मात्राबी, एन(बी), मोल:
कहाँ एन(बी)– कणों की संख्या बी;
एन ए– अवोगाद्रो स्थिरांक (एन ए = 6.0210 23 मोल -1).
किसी पदार्थ का मोलर द्रव्यमानवी, एम(वी), जी/मोल:
कहाँ टी(वी)– द्रव्यमान बी.
गैस का मोलर आयतनमें, वी एमएल/मोल:
कहाँ वी एम = 22.4 एल/मोल (एवोगैड्रो के नियम का परिणाम), सामान्य परिस्थितियों में (एन.एस. - वायुमंडलीय दबाव) पी = 101,325 पा (1 एटीएम); थर्मोडायनामिक तापमान टी = 273.15 K या सेल्सियस तापमान टी = 0 डिग्री सेल्सियस)।
बी हाइड्रोजन के लिए, डी(गैस बी बाय एच 2):
*गैसीय पदार्थ का घनत्वमें हवाई मार्ग से, डी(हवा के ऊपर गैस बी): तत्व का द्रव्यमान अंशइ मामले मेंवी, डब्ल्यू(ई):जहाँ x पदार्थ B के सूत्र में E परमाणुओं की संख्या है
परमाणु की संरचना और आवर्त नियम डी.आई. मेंडलीव
द्रव्यमान संख्या (ए) - परमाणु नाभिक में प्रोटॉन और न्यूट्रॉन की कुल संख्या:
ए = एन(पी 0) + एन(पी +).
परमाणु परमाणु प्रभार (Z)नाभिक में प्रोटॉन की संख्या और परमाणु में इलेक्ट्रॉनों की संख्या के बराबर:Z = N(p+) = N(e¯).
आइसोटोप- एक ही तत्व के परमाणु, नाभिक में न्यूट्रॉन की संख्या में भिन्न, उदाहरण के लिए: पोटेशियम-39: 39 K (19 पी + , 20एन 0, 19इ); पोटैशियम-40: 40 K (19 पी+, 21एन 0, 19e¯).*ऊर्जा स्तर और उपस्तर
*परमाणु कक्षक(एओ) अंतरिक्ष के उस क्षेत्र की विशेषता बताता है जिसमें एक निश्चित ऊर्जा वाले इलेक्ट्रॉन के स्थित होने की संभावना सबसे अधिक होती है।*एस- और पी-ऑर्बिटल्स के आकार
आवधिक कानून और आवधिक प्रणाली डी.आई. मेंडलीव
तत्वों और उनके यौगिकों के गुण समय-समय पर बढ़ते परमाणु क्रमांक के साथ दोहराए जाते हैं, जो तत्व के परमाणु के नाभिक के आवेश के बराबर होता है।अवधि संख्यामेल खाती है इलेक्ट्रॉनों से भरे ऊर्जा स्तरों की संख्या,और के लिए खड़ा है भरा जाने वाला अंतिम ऊर्जा स्तर(यूरोपीय संघ)।
समूह संख्या एदिखाता है और वगैरह।
समूह संख्या बीदिखाता है वैलेंस इलेक्ट्रॉनों की संख्या एन.एसऔर (एन - 1)डी.
एस-तत्व अनुभाग- ऊर्जा उपस्तर (ईएसएल) इलेक्ट्रॉनों से भरा होता है एनएस-ईपीयू– IA- और IIA-समूह, H और He.
पी-तत्व अनुभाग– इलेक्ट्रॉनों से भरा हुआ एनपी-ईपीयू– IIIA-VIIIA-समूह।
डी-तत्व अनुभाग– इलेक्ट्रॉनों से भरा हुआ (पी- 1) डी-ईपीयू - आईबी-VIIIB2-समूह।
एफ-तत्व अनुभाग– इलेक्ट्रॉनों से भरा हुआ (पी-2) एफ-ईपीयू - लैंथेनाइड्स और एक्टिनाइड्स।
आवर्त सारणी के तीसरे आवर्त के तत्वों के हाइड्रोजन यौगिकों की संरचना और गुणों में परिवर्तन
गैर-वाष्पशील, पानी के साथ विघटित होता है: NaH, MgH 2, AlH 3।अस्थिर: SiH 4, PH 3, H 2 S, HCl।
आवर्त सारणी के तीसरे आवर्त के तत्वों के उच्च ऑक्साइड और हाइड्रॉक्साइड की संरचना और गुणों में परिवर्तन
बुनियादी: Na 2 O - NaOH, MgO - Mg(OH) 2.उभयधर्मी:अल 2 ओ 3 - अल(ओएच) 3.
अम्लीय: SiO 2 - H 4 SiO 4, P 2 O 5 - H 3 PO 4, SO 3 - H 2 SO 4, सीएल 2 O 7 - HClO 4।
रासायनिक बंध
वैद्युतीयऋणात्मकता(χ) एक मात्रा है जो किसी अणु में परमाणु की ऋणात्मक आवेश प्राप्त करने की क्षमता को दर्शाती है।सहसंयोजक बंधन निर्माण के तंत्र
विनिमय तंत्र- पड़ोसी परमाणुओं की दो कक्षाओं का ओवरलैप, जिनमें से प्रत्येक में एक इलेक्ट्रॉन था।दाता-स्वीकर्ता तंत्र- एक परमाणु के मुक्त कक्षक का दूसरे परमाणु के कक्षक के साथ ओवरलैप होना जिसमें इलेक्ट्रॉनों की एक जोड़ी होती है।
आबंध निर्माण के दौरान कक्षकों का ओवरलैप होना
*संकरण का प्रकार - कण का ज्यामितीय आकार - बंधों के बीच का कोण
केंद्रीय परमाणु कक्षकों का संकरण- उनकी ऊर्जा और रूप का संरेखण।एसपी- रैखिक - 180°
एसपी 2– त्रिकोणीय – 120°
एसपी 3– चतुष्फलकीय – 109.5°
एसपी 3 डी- त्रिकोणीय-द्विपिरामिडल - 90°; 120°
एसपी 3 डी 2– अष्टफलकीय – 90°
मिश्रण और समाधान
समाधान- दो या दो से अधिक पदार्थों से बनी एक सजातीय प्रणाली, जिसकी सामग्री कुछ सीमाओं के भीतर भिन्न हो सकती है।
समाधान:विलायक (जैसे पानी) + विलेय।
सच्चा समाधानइनमें 1 नैनोमीटर से छोटे कण होते हैं।
कोलाइडल समाधानइनमें 1 से 100 नैनोमीटर तक के आकार के कण होते हैं।
यांत्रिक मिश्रण(निलंबन) में 100 नैनोमीटर से बड़े कण होते हैं।
निलंबन=> ठोस + तरल
पायसन=> तरल + तरल
फोम, कोहरा=> गैस + तरल
विषमांगी मिश्रण अलग हो जाते हैंव्यवस्थित करना और छानना।
सजातीय मिश्रण अलग हो जाते हैंवाष्पीकरण, आसवन, क्रोमैटोग्राफी।
संतृप्त घोलविलेय के साथ संतुलन में है या हो सकता है (यदि विलेय ठोस है, तो इसकी अधिकता अवक्षेप में होती है)।
घुलनशीलता- किसी दिए गए तापमान पर संतृप्त घोल में घुले पदार्थ की सामग्री।
असंतृप्त घोल कम,
अतिसंतृप्त घोलविलेय शामिल है अधिक,किसी दिए गए तापमान पर इसकी घुलनशीलता की तुलना में।
समाधान में भौतिक रासायनिक मात्राओं के बीच संबंध
विलेय का द्रव्यमान अंशमें, डब्ल्यू(बी);एक इकाई का अंश या %:कहाँ टी(वी)– द्रव्यमान बी,
टी(आर)– समाधान का द्रव्यमान.
समाधान का वजन,एम(पी), जी:
एम(पी) = एम(बी) + एम(एच 2 ओ) = वी(पी) ρ(पी),
जहाँ F(p) विलयन का आयतन है;ρ(पी) - समाधान घनत्व।
समाधान की मात्रा, वी(पी),मैं:
दाढ़ एकाग्रता, s(V), mol/l:जहां n(B) पदार्थ B की मात्रा है;
एम(बी) - पदार्थ बी का दाढ़ द्रव्यमान।
समाधान की संरचना बदलना
घोल को पानी से पतला करना:> टी"(वी)= टी(बी);
> घोल का द्रव्यमान मिलाए गए पानी के द्रव्यमान से बढ़ता है: एम"(पी) = एम(पी) + एम(एच 2 ओ)।
किसी घोल से पानी का वाष्पीकरण:
> विलेय का द्रव्यमान नहीं बदलता: टी"(बी) = टी(बी).
> वाष्पित जल के द्रव्यमान से घोल का द्रव्यमान घट जाता है: एम"(पी) = एम(पी) – एम(एच 2 ओ)।
दो समाधानों का विलय:विलयनों का द्रव्यमान, साथ ही घुले हुए पदार्थ का द्रव्यमान, जुड़ते हैं:
टी"(बी) = टी(बी) + टी"(बी);
टी"(पी) = टी(पी) + टी"(पी).
क्रिस्टल ड्रॉप:अवक्षेपित क्रिस्टल के द्रव्यमान से विलेय का द्रव्यमान और घोल का द्रव्यमान कम हो जाता है:
एम"(बी) = एम(बी) - एम(तलछट); एम"(पी) = एम(पी) - एम(तलछट)।
पानी का द्रव्यमान नहीं बदलता.
किसी रासायनिक प्रतिक्रिया का ऊष्मीय प्रभाव
*किसी पदार्थ के निर्माण की एन्थैल्पी ΔH°(B), kJ/mol, साधारण पदार्थों से उनके मानक अवस्थाओं में 1 मोल पदार्थ के निर्माण की प्रतिक्रिया की एन्थैल्पी है, अर्थात स्थिर दबाव पर (सिस्टम में प्रत्येक गैस के लिए 1 एटीएम या कुल पर) गैसीय प्रतिक्रिया प्रतिभागियों की अनुपस्थिति में 1 एटीएम का दबाव) और स्थिर तापमान (आमतौर पर 298 K) , या 25 डिग्री सेल्सियस)।*रासायनिक प्रतिक्रिया का तापीय प्रभाव (हेस का नियम)
क्यू = Σक्यू(उत्पाद)- ΣQ(अभिकर्मक)।
ΔН° = ΣΔН°(उत्पाद) - Σ ΔН°(अभिकर्मक)।
प्रतिक्रिया के लिए एए + बीबी +… = डीडी + ईई +…ΔH° = (dΔH°(D) + eΔH°(E) +…) – (aΔH°(A) + bΔH°(B) +…),
कहाँ ए, बी, डी, ई- प्रतिक्रिया समीकरण में गुणांक के अनुरूप पदार्थों की स्टोइकोमेट्रिक मात्रा।रासायनिक प्रतिक्रिया दर
यदि समय के दौरान τ आयतन में वीअभिकारक या उत्पाद की मात्रा में Δ द्वारा परिवर्तन किया गया एन,गति प्रतिक्रिया:
एक मोनोमोलेक्यूलर प्रतिक्रिया के लिए ए →…:
वी = केसीए)।
द्विआण्विक प्रतिक्रिया के लिए ए + बी → ...:वी = केसी(ए) सी(बी).
त्रिआण्विक प्रतिक्रिया के लिए ए + बी + सी → ...:वी = केसी(ए) सी(बी) सी(सी).
रासायनिक प्रतिक्रिया की दर बदलना
गति प्रतिक्रिया बढ़ोतरी:1)रासायनिक रूप से सक्रियअभिकर्मक;
2) पदोन्नतिअभिकर्मक सांद्रता;
3) बढ़ोतरी
4) पदोन्नतितापमान;
5) उत्प्रेरक.गति प्रतिक्रिया कम करना:
1)रासायनिक रूप से निष्क्रियअभिकर्मक;
2) पदावनतिअभिकर्मक सांद्रता;
3) घटानाठोस और तरल अभिकर्मकों की सतहें;
4) पदावनतितापमान;
5) अवरोधक.
*तापमान गति गुणांक(γ) उस संख्या के बराबर है जो दर्शाती है कि तापमान दस डिग्री बढ़ने पर प्रतिक्रिया दर कितनी गुना बढ़ जाती है:
रासायनिक संतुलन
*रासायनिक संतुलन के लिए सामूहिक क्रिया का नियम:संतुलन की स्थिति में, उत्पादों की दाढ़ सांद्रता के उत्पाद का अनुपात शक्तियों के बराबर होता है
उनके स्टोइकोमेट्रिक गुणांक, उनके स्टोइकोमेट्रिक गुणांक के बराबर शक्तियों में अभिकारकों की दाढ़ सांद्रता के उत्पाद के लिए, एक स्थिर तापमान पर एक स्थिर मूल्य है (एकाग्रता संतुलन स्थिरांक).
प्रतिवर्ती प्रतिक्रिया के लिए रासायनिक संतुलन की स्थिति में:
एए + बीबी + … ↔ डीडी + एफएफ + …
के सी = [डी] डी [एफ] एफ .../ [ए] ए [बी] बी ...
*उत्पादों के निर्माण की ओर रासायनिक संतुलन में बदलाव
1) अभिकर्मकों की सांद्रता बढ़ाना;2) उत्पादों की सांद्रता को कम करना;
3) तापमान में वृद्धि (एंडोथर्मिक प्रतिक्रिया के लिए);
4) तापमान में कमी (एक्ज़ोथिर्मिक प्रतिक्रिया के लिए);
5) दबाव में वृद्धि (मात्रा में कमी के साथ होने वाली प्रतिक्रिया के लिए);
6) दबाव में कमी (आयतन में वृद्धि के साथ होने वाली प्रतिक्रिया के लिए)।
समाधान में प्रतिक्रियाओं का आदान-प्रदान करें
इलेक्ट्रोलाइटिक पृथक्करण- जब कुछ पदार्थ पानी में घुल जाते हैं तो आयन (धनायन और ऋणायन) बनने की प्रक्रिया।
अम्लका गठन कर रहे हैं हाइड्रोजन धनायनऔर अम्ल आयन,उदाहरण के लिए:
HNO 3 = H + + NO 3 ¯
इलेक्ट्रोलाइटिक पृथक्करण के दौरान कारणका गठन कर रहे हैं धातु धनायनऔर हाइड्रॉक्साइड आयन, उदाहरण के लिए:NaOH = Na + + OH¯
इलेक्ट्रोलाइटिक पृथक्करण के दौरान लवण(मध्यम, दोहरा, मिश्रित) बनते हैं धातु धनायनऔर एसिड आयन, उदाहरण के लिए:NaNO 3 = Na + + NO 3 ¯
KAl(SO 4) 2 = K + + Al 3+ + 2SO 4 2-
इलेक्ट्रोलाइटिक पृथक्करण के दौरान अम्ल लवणका गठन कर रहे हैं धातु धनायनऔर एसिड हाइड्रोअनियन, उदाहरण के लिए:NaHCO 3 = Na + + HCO 3 ‾
कुछ प्रबल अम्ल
HBr, HCl, HClO 4, H 2 Cr 2 O 7, HI, HMnO 4, H 2 SO 4, H 2 SeO 4, HNO 3, H 2 CrO 4कुछ मजबूत कारण
RbOH, CsOH, KOH, NaOH, LiOH, Ba(OH) 2, Sr(OH) 2, Ca(OH) 2पृथक्करण डिग्री α-विघटित कणों की संख्या और प्रारंभिक कणों की संख्या का अनुपात।
स्थिर मात्रा में:
पृथक्करण की डिग्री के आधार पर पदार्थों का वर्गीकरण
बर्थोलेट का नियम
समाधान में विनिमय प्रतिक्रियाएं अपरिवर्तनीय रूप से आगे बढ़ती हैं यदि परिणाम एक अवक्षेप, गैस या कमजोर इलेक्ट्रोलाइट का निर्माण होता है।आणविक और आयनिक प्रतिक्रिया समीकरणों के उदाहरण
1. आणविक समीकरण: CuCl 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaCl"पूर्ण" आयनिक समीकरण: Cu 2+ + 2Сl¯ + 2Na + + 2OH¯ = Cu(OH) 2 ↓ + 2Na + + 2Сl¯
"लघु" आयनिक समीकरण: Cu 2+ + 2OH¯ = Cu(OH) 2 ↓
2. आणविक समीकरण: FeS (T) + 2HCl = FeCl 2 + H 2 S
"पूर्ण" आयनिक समीकरण: FeS + 2H + + 2Сl¯ = Fe 2+ + 2Сl¯ + H 2 S
"लघु" आयनिक समीकरण: FeS (T) + 2H + = Fe 2+ + H 2 S
3. आणविक समीकरण: 3HNO 3 + K 3 PO 4 = H 3 PO 4 + 3KNO 3
"पूर्ण" आयनिक समीकरण: 3H + + 3NO 3 ¯ + 3K + + PO 4 3- = H 3 PO 4 + 3K + + 3NO 3 ¯
"लघु" आयनिक समीकरण: 3H + + PO 4 3- = H 3 PO 4
*हाइड्रोजन मूल्य
(पीएच) पीएच = - लॉग = 14 + लॉग*पतले जलीय घोल के लिए पीएच रेंज
पीएच 7 (तटस्थ वातावरण)विनिमय प्रतिक्रियाओं के उदाहरण
निराकरण प्रतिक्रिया- एक विनिमय प्रतिक्रिया जो तब होती है जब अम्ल और क्षार परस्पर क्रिया करते हैं।1. क्षार + प्रबल अम्ल: Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Ba 2+ + 2ON¯ + 2H + + 2Сl¯ = Ba 2+ + 2Сl¯ + 2Н 2 O
एच + + ओएच¯ = एच 2 ओ
2. थोड़ा घुलनशील आधार + मजबूत अम्ल: Cu(OH) 2(t) + 2HCl = CuCl 2 + 2H 2 O
Cu(OH) 2 + 2H + + 2Cl¯ = Cu 2+ + 2Cl¯ + 2H 2 O
Cu(OH) 2 + 2H + = Cu 2+ + 2H 2 O
*हाइड्रोलिसिस- परमाणुओं की ऑक्सीकरण अवस्था को बदले बिना किसी पदार्थ और पानी के बीच विनिमय प्रतिक्रिया।
1. द्विआधारी यौगिकों का अपरिवर्तनीय हाइड्रोलिसिस:
एमजी 3 एन 2 + 6एच 2 ओ = 3एमजी(ओएच) 2 + 2एनएच 3
2. लवणों का प्रतिवर्ती जल अपघटन:
ए) नमक बनता है एक मजबूत आधार धनायन और एक मजबूत एसिड आयन:
NaCl = Na + + Сl¯
ना + + एच 2 ओ ≠ ;
सीएल¯ + एच 2 ओ ≠
कोई हाइड्रोलिसिस नहीं है; तटस्थ वातावरण, पीएच = 7.
बी) नमक बनता है एक मजबूत आधार धनायन और एक कमजोर अम्ल आयन:
Na 2 S = 2Na + + S 2-
ना + + एच 2 ओ ≠
एस 2- + एच 2 ओ ↔ एचएस¯ + ओएच¯
आयनों द्वारा हाइड्रोलिसिस; क्षारीय वातावरण, pH >7.
बी) नमक बनता है एक कमजोर या थोड़ा घुलनशील आधार का एक धनायन और एक मजबूत एसिड का एक आयन:
परिचयात्मक अंश का अंत.
पाठ लीटर एलएलसी द्वारा प्रदान किया गया।
आप पुस्तक के लिए सुरक्षित रूप से वीज़ा, मास्टरकार्ड, मेस्ट्रो बैंक कार्ड से, मोबाइल फ़ोन खाते से, भुगतान टर्मिनल से, एमटीएस या सिवाज़्नॉय स्टोर में, PayPal, WebMoney, Yandex.Money, QIWI वॉलेट, बोनस कार्ड या के माध्यम से भुगतान कर सकते हैं। आपके लिए सुविधाजनक एक और तरीका।
जानकारी जांचें. इस आलेख में प्रस्तुत तथ्यों की सत्यता एवं जानकारी की विश्वसनीयता की जाँच करना आवश्यक है। वार्ता पृष्ठ पर इस विषय पर चर्चा है: शब्दावली के संबंध में संदेह। रासायनिक सूत्र...विकिपीडिया
एक रासायनिक सूत्र रासायनिक प्रतीकों, संख्याओं और कोष्ठक के विभाजन प्रतीकों का उपयोग करके पदार्थों की संरचना और संरचना के बारे में जानकारी दर्शाता है। वर्तमान में, निम्नलिखित प्रकार के रासायनिक सूत्र प्रतिष्ठित हैं: सबसे सरल सूत्र। अनुभवी द्वारा प्राप्त किया जा सकता है... ...विकिपीडिया
एक रासायनिक सूत्र रासायनिक प्रतीकों, संख्याओं और कोष्ठक के विभाजन प्रतीकों का उपयोग करके पदार्थों की संरचना और संरचना के बारे में जानकारी दर्शाता है। वर्तमान में, निम्नलिखित प्रकार के रासायनिक सूत्र प्रतिष्ठित हैं: सबसे सरल सूत्र। अनुभवी द्वारा प्राप्त किया जा सकता है... ...विकिपीडिया
एक रासायनिक सूत्र रासायनिक प्रतीकों, संख्याओं और कोष्ठक के विभाजन प्रतीकों का उपयोग करके पदार्थों की संरचना और संरचना के बारे में जानकारी दर्शाता है। वर्तमान में, निम्नलिखित प्रकार के रासायनिक सूत्र प्रतिष्ठित हैं: सबसे सरल सूत्र। अनुभवी द्वारा प्राप्त किया जा सकता है... ...विकिपीडिया
एक रासायनिक सूत्र रासायनिक प्रतीकों, संख्याओं और कोष्ठक के विभाजन प्रतीकों का उपयोग करके पदार्थों की संरचना और संरचना के बारे में जानकारी दर्शाता है। वर्तमान में, निम्नलिखित प्रकार के रासायनिक सूत्र प्रतिष्ठित हैं: सबसे सरल सूत्र। अनुभवी द्वारा प्राप्त किया जा सकता है... ...विकिपीडिया
मुख्य लेख: अकार्बनिक यौगिक, तत्व के अनुसार अकार्बनिक यौगिकों की सूची, प्रत्येक पदार्थ के लिए वर्णानुक्रम में (सूत्र द्वारा) प्रस्तुत अकार्बनिक यौगिकों की सूचनात्मक सूची, तत्वों के हाइड्रोजन एसिड (यदि ... विकिपीडिया)
इस लेख या अनुभाग में संशोधन की आवश्यकता है. कृपया लेख लिखने के नियमों के अनुसार लेख में सुधार करें...विकिपीडिया
रासायनिक समीकरण (रासायनिक प्रतिक्रिया का समीकरण) रासायनिक सूत्रों, संख्यात्मक गुणांक और गणितीय प्रतीकों का उपयोग करके रासायनिक प्रतिक्रिया का एक पारंपरिक प्रतिनिधित्व है। रासायनिक प्रतिक्रिया का समीकरण गुणात्मक और मात्रात्मक देता है... विकिपीडिया
रासायनिक सॉफ्टवेयर रसायन विज्ञान के क्षेत्र में उपयोग किए जाने वाले कंप्यूटर प्रोग्राम हैं। सामग्री 1 रासायनिक संपादक 2 प्लेटफार्म 3 साहित्य...विकिपीडिया
पुस्तकें
- औद्योगिक उपकरणों की स्थापना के लिए जापानी-अंग्रेज़ी-रूसी शब्दकोश। लगभग 8,000 शब्द, पोपोवा आई.एस. शब्दकोश उपयोगकर्ताओं की एक विस्तृत श्रृंखला के लिए है और मुख्य रूप से जापान से औद्योगिक उपकरणों की आपूर्ति और कार्यान्वयन में शामिल अनुवादकों और तकनीकी विशेषज्ञों के लिए है।
- जैव रासायनिक शब्दों का एक संक्षिप्त शब्दकोश, कुनिज़ेव एस.एम.। शब्दकोश सामान्य जैव रसायन, पारिस्थितिकी और जैव प्रौद्योगिकी के बुनियादी सिद्धांतों में पाठ्यक्रम का अध्ययन करने वाले विश्वविद्यालयों में रासायनिक और जैविक विशिष्टताओं के छात्रों के लिए है, और इसका उपयोग इसमें भी किया जा सकता है ...
कई बुनियादी अवधारणाएँ और सूत्र।
सभी पदार्थों का द्रव्यमान, घनत्व और आयतन अलग-अलग होता है। एक तत्व से धातु का एक टुकड़ा किसी अन्य धातु के बिल्कुल समान आकार के टुकड़े से कई गुना अधिक वजन का हो सकता है।
तिल(मोल्स की संख्या)
पद का नाम: तिल, अंतरराष्ट्रीय: मोल- किसी पदार्थ की मात्रा मापने की एक इकाई। इसमें मौजूद पदार्थ की मात्रा के अनुरूप है एन.ए.कण (अणु, परमाणु, आयन) इसलिए, एक सार्वभौमिक मात्रा पेश की गई - मोल्स की संख्या.कार्यों में अक्सर पाया जाने वाला वाक्यांश है "प्राप्त..." पदार्थ का मोल"
एन.ए.= 6.02 1023
एन.ए.- अवोगाद्रो का नंबर। साथ ही "सहमति से एक संख्या।" पेंसिल की नोक में कितने परमाणु होते हैं? लगभग एक हजार. इतनी मात्रा में काम करना सुविधाजनक नहीं है। इसलिए, दुनिया भर के रसायनज्ञ और भौतिक विज्ञानी सहमत हुए - आइए 6.02 × 1023 कणों (परमाणु, अणु, आयन) को नामित करें 1 तिल पदार्थों.
1 मोल = 6.02 1023 कण
यह समस्याओं को हल करने के बुनियादी सूत्रों में से पहला था।
किसी पदार्थ का मोलर द्रव्यमान
दाढ़ जनपदार्थ एक का द्रव्यमान है पदार्थ का मोल.
श्री के रूप में दर्शाया गया यह आवर्त सारणी के अनुसार पाया जाता है - यह किसी पदार्थ के परमाणु द्रव्यमान का योग मात्र है।
उदाहरण के लिए, हमें सल्फ्यूरिक एसिड - H2SO4 दिया जाता है। आइए किसी पदार्थ के दाढ़ द्रव्यमान की गणना करें: परमाणु द्रव्यमान H = 1, S-32, O-16।
श्री(H2SO4)=1 2+32+16 4=98 g\mol.
समस्या समाधान के लिए दूसरा आवश्यक सूत्र है
पदार्थ द्रव्यमान सूत्र:
अर्थात्, किसी पदार्थ का द्रव्यमान ज्ञात करने के लिए, आपको मोल्स (n) की संख्या जानने की आवश्यकता है, और हम आवर्त सारणी से दाढ़ द्रव्यमान ज्ञात करते हैं।
द्रव्यमान संरक्षण का नियम -रासायनिक प्रतिक्रिया में प्रवेश करने वाले पदार्थों का द्रव्यमान हमेशा परिणामी पदार्थों के द्रव्यमान के बराबर होता है।
यदि हम प्रतिक्रिया करने वाले पदार्थों का द्रव्यमान जानते हैं, तो हम उस प्रतिक्रिया के उत्पादों का द्रव्यमान ज्ञात कर सकते हैं। और इसके विपरीत।
रसायन विज्ञान की समस्याओं को हल करने का तीसरा सूत्र है
पदार्थ का आयतन:
क्षमा करें, यह छवि हमारे दिशानिर्देशों के अनुरूप नहीं है। प्रकाशन जारी रखने के लिए, कृपया छवि हटा दें या दूसरी अपलोड करें।संख्या 22.4 कहाँ से आई? से अवोगाद्रो का नियम:
समान तापमान और दबाव पर ली गई विभिन्न गैसों की समान मात्रा में अणुओं की संख्या समान होती है।
एवोगैड्रो के नियम के अनुसार, सामान्य परिस्थितियों में एक आदर्श गैस के 1 मोल का आयतन समान होता है वीएम= 22.413 996(39) एल
अर्थात्, यदि समस्या में हमें सामान्य स्थितियाँ दी गई हैं, तो मोल्स (n) की संख्या जानकर, हम पदार्थ का आयतन ज्ञात कर सकते हैं।
इसलिए, समस्याओं को हल करने के लिए बुनियादी सूत्ररसायन शास्त्र में
अवोगाद्रो की संख्याएन.ए.
6.02 1023 कण
पदार्थ की मात्राएन (मोल)
n=V\22.4 (l\mol)
पदार्थ का द्रव्यमानएम (जी)
पदार्थ का आयतन V(एल)
V=n 22.4 (l\mol)
क्षमा करें, यह छवि हमारे दिशानिर्देशों के अनुरूप नहीं है। प्रकाशन जारी रखने के लिए, कृपया छवि हटा दें या दूसरी अपलोड करें।ये सूत्र हैं. अक्सर, समस्याओं को हल करने के लिए, आपको सबसे पहले प्रतिक्रिया समीकरण लिखना होगा और (आवश्यक!) गुणांकों को व्यवस्थित करना होगा - उनका अनुपात प्रक्रिया में मोल्स का अनुपात निर्धारित करता है।
मुख्य शब्द: रसायन विज्ञान 8वीं कक्षा। सभी सूत्र और परिभाषाएँ, भौतिक मात्राओं के प्रतीक, माप की इकाइयाँ, माप की इकाइयों को निर्दिष्ट करने के लिए उपसर्ग, इकाइयों के बीच संबंध, रासायनिक सूत्र, मूल परिभाषाएँ, संक्षेप में, तालिकाएँ, चित्र।
1. प्रतीक, नाम और माप की इकाइयाँ
रसायन विज्ञान में प्रयुक्त कुछ भौतिक मात्राएँ
| भौतिक मात्रा | पद का नाम | इकाई |
| समय | टी | साथ |
| दबाव | पी | पा, केपीए |
| पदार्थ की मात्रा | ν | तिल |
| पदार्थ का द्रव्यमान | एम | किग्रा, जी |
| सामूहिक अंश | ω | आयामरहित |
| दाढ़ जन | एम | किग्रा/मोल, जी/मोल |
| मोलर आयतन | वीएन | एम 3 /मोल, एल/मोल |
| पदार्थ का आयतन | वी | एम 3, एल |
| वॉल्यूम फ़्रैक्शन | आयामरहित | |
| सापेक्ष परमाणु द्रव्यमान | एक आर | आयामरहित |
| श्री | आयामरहित | |
| गैस A से गैस B का सापेक्ष घनत्व | डीबी ० ए) | आयामरहित |
| पदार्थ का घनत्व | आर | किग्रा/एम 3, जी/सेमी 3, जी/एमएल |
| अवोगाद्रो स्थिरांक | एन ए | 1/मोल |
| निरपेक्ष तापमान | टी | के (केल्विन) |
| तापमान सेल्सियस में | टी | डिग्री सेल्सियस (डिग्री सेल्सियस) |
| किसी रासायनिक प्रतिक्रिया का ऊष्मीय प्रभाव | क्यू | केजे/मोल |

2. भौतिक राशियों की इकाइयों के बीच संबंध

3. 8वीं कक्षा में रासायनिक सूत्र
4. 8वीं कक्षा में बुनियादी परिभाषाएँ

- एटम- किसी पदार्थ का सबसे छोटा रासायनिक रूप से अविभाज्य कण।
- रासायनिक तत्व- एक निश्चित प्रकार का परमाणु।
- अणु- किसी पदार्थ का सबसे छोटा कण जो अपनी संरचना और रासायनिक गुणों को बरकरार रखता है और परमाणुओं से बना होता है।
- सरल पदार्थ- ऐसे पदार्थ जिनके अणुओं में एक ही प्रकार के परमाणु होते हैं।
- जटिल पदार्थ- ऐसे पदार्थ जिनके अणुओं में विभिन्न प्रकार के परमाणु होते हैं।
- पदार्थ की गुणात्मक संरचना दिखाता है कि इसमें किन तत्वों के परमाणु शामिल हैं।
- पदार्थ की मात्रात्मक संरचना इसकी संरचना में प्रत्येक तत्व के परमाणुओं की संख्या को दर्शाता है।
- रासायनिक सूत्र- रासायनिक प्रतीकों और सूचकांकों का उपयोग करके किसी पदार्थ की गुणात्मक और मात्रात्मक संरचना की पारंपरिक रिकॉर्डिंग।
- परमाण्विक भार इकाई(एएमयू) - परमाणु द्रव्यमान की माप की एक इकाई, कार्बन परमाणु 12 सी के 1/12 के द्रव्यमान के बराबर।
- तिल- किसी पदार्थ की वह मात्रा जिसमें 0.012 किलोग्राम कार्बन 12 सी में परमाणुओं की संख्या के बराबर कणों की संख्या होती है।
- अवोगाद्रो स्थिरांक (ना = 6*10 23 मोल -1) - एक मोल में निहित कणों की संख्या।
- किसी पदार्थ का मोलर द्रव्यमान (एम ) 1 मोल की मात्रा में लिए गए पदार्थ का द्रव्यमान है।
- सापेक्ष परमाणु द्रव्यमानतत्व ए आर - किसी दिए गए तत्व m 0 के परमाणु के द्रव्यमान का कार्बन परमाणु 12 C के द्रव्यमान के 1/12 से अनुपात।
- सापेक्ष आणविक भारपदार्थों एम आर - किसी दिए गए पदार्थ के अणु के द्रव्यमान का कार्बन परमाणु 12 C के द्रव्यमान के 1/12 से अनुपात। सापेक्ष आणविक द्रव्यमान यौगिक बनाने वाले रासायनिक तत्वों के सापेक्ष परमाणु द्रव्यमान के योग के बराबर है, लेते हुए किसी दिए गए तत्व के परमाणुओं की संख्या को ध्यान में रखें।
- सामूहिक अंशरासायनिक तत्व ω(एक्स)यह दर्शाता है कि पदार्थ X के सापेक्ष आणविक द्रव्यमान का कितना हिस्सा किसी दिए गए तत्व के लिए जिम्मेदार है।
परमाणु-आणविक शिक्षण
1. आणविक और गैर-आणविक संरचना वाले पदार्थ होते हैं।
2. अणुओं के बीच अंतराल होते हैं, जिनका आकार पदार्थ के एकत्रीकरण की स्थिति और तापमान पर निर्भर करता है।
3. अणु निरंतर गति में रहते हैं।
4. अणु परमाणुओं से बने होते हैं।
6. परमाणुओं की विशेषता एक निश्चित द्रव्यमान और आकार होती है।
भौतिक घटनाओं के दौरान, अणु संरक्षित रहते हैं, रासायनिक घटनाओं के दौरान, एक नियम के रूप में, वे नष्ट हो जाते हैं। रासायनिक घटनाओं के दौरान परमाणु पुनर्व्यवस्थित होते हैं, जिससे नए पदार्थों के अणु बनते हैं।

पदार्थ की निरंतर संरचना का नियम
आणविक संरचना के प्रत्येक रासायनिक रूप से शुद्ध पदार्थ, तैयारी की विधि की परवाह किए बिना, एक निरंतर गुणात्मक और मात्रात्मक संरचना होती है।
वैलेंस
संयोजकता किसी रासायनिक तत्व के परमाणु का किसी अन्य तत्व के परमाणुओं की एक निश्चित संख्या को जोड़ने या प्रतिस्थापित करने का गुण है।

रासायनिक प्रतिक्रिया
रासायनिक प्रतिक्रिया एक ऐसी घटना है जिसके परिणामस्वरूप एक पदार्थ से अन्य पदार्थ बनते हैं। अभिकारक वे पदार्थ हैं जो रासायनिक प्रतिक्रिया में प्रवेश करते हैं। प्रतिक्रिया उत्पाद वे पदार्थ हैं जो प्रतिक्रिया के परिणामस्वरूप बनते हैं।
रासायनिक प्रतिक्रियाओं के संकेत:
1. ऊष्मा (प्रकाश) का निकलना।
2. रंग बदलना.
3. दुर्गन्ध प्रकट होती है।
4. तलछट का निर्माण.
5. गैस निकलना.




 वी एम= 22.4 एल/मोल (एन.एस.)
वी एम= 22.4 एल/मोल (एन.एस.)