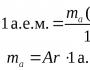රසායන විද්යාවේ සූත්ර එකතුව. ගැටළු විසඳීම සඳහා මූලික සූත්ර
|
විශාලත්වය සහ එහි මානය |
අනුපාතය |
|
X මූලද්රව්යයේ පරමාණුක ස්කන්ධය (සාපේක්ෂ) |
|
|
මූලද්රව්ය අනුක්රමික අංකය |
Z= එන්(ඊ –) = එන්(ආර් +) |
|
X ද්රව්යයේ E මූලද්රව්යයේ ස්කන්ධ භාගය, ඒකකයක භාගවල, % කින්) |
|
|
ද්රව්යයේ ප්රමාණය X, mol | |
|
ගෑස් ද්රව්ය ප්රමාණය, mol |
හොඳින්. – ආර්= 101 325 Pa, ටී= 273 K |
|
ද්රව්යයේ Molar ස්කන්ධය X, g/mol, kg/mol |
|
|
ද්රව්යයේ ස්කන්ධය X, g, kg |
එම්(X) = n(X) එම්(X) |
|
වායුවේ Molar පරිමාව, l / mol, m 3 / mol |
වී එම්= 22.4 l/mol එන්.එස්. |
|
ගෑස් පරිමාව, m 3 |
වී = වී එම් × n |
|
නිෂ්පාදන අස්වැන්න |
|
|
ද්රව්යයේ ඝනත්වය X, g/l, g/ml, kg/m 3 |
|
|
හයිඩ්රජන් මගින් X වායුමය ද්රව්යයේ ඝනත්වය |
|
|
වාතයේ X වායුමය ද්රව්යයේ ඝනත්වය |
එම්(වාතය) = 29 g/mol |
|
එක්සත් ගෑස් නීතිය |
|
|
Mendeleev-Clapeyron සමීකරණය |
පී.වී = nRT, ආර්= 8.314 J/mol×K |
|
වායු මිශ්රණයක ඇති වායුමය ද්රව්යයේ පරිමා භාගය, ඒකකයක භාග වශයෙන් හෝ % කින් |
|
|
වායු මිශ්රණයක මවුල ස්කන්ධය |
|
|
මිශ්රණයක ද්රව්යයක (X) මවුල කොටස |
|
|
තාප ප්රමාණය, J, kJ |
ප්රශ්නය = n(X) ප්රශ්නය(X) |
|
ප්රතික්රියාවේ තාප බලපෑම |
Q =-එච් |
|
X, J/mol, kJ/mol ද්රව්ය සෑදීමේ තාපය |
|
|
රසායනික ප්රතික්රියා අනුපාතය (mol/lsec) |
|
|
මහා ක්රියාකාරී නීතිය (සරල ප්රතික්රියාවක් සඳහා) |
ඒ A+ වී B= සමග C + ඈඩී u = කේ සමග ඒ(A) සමග වී(බී) |
|
වැන්ට් හොෆ්ගේ නියමය |
|
|
ද්රව්යයේ ද්රාව්යතාව (X) (g/100 g ද්රාවකය) |
|
|
A + X මිශ්රණයේ X ද්රව්යයේ ස්කන්ධ භාගය, ඒකකයක භාග වශයෙන්, % |
|
|
ද්රාවණයේ බර, g, kg |
එම්(rr) = එම්(X)+ එම්(H2O) එම්(rr) = වී(rr) (rr) |
|
ද්රාවණයක ද්රාවණය වූ ද්රව්යයේ ස්කන්ධ භාගය, ඒකකයක කොටස් වශයෙන්, % |
|
|
විසඳුම් ඝනත්වය |
|
|
විසඳුමේ පරිමාව, cm 3, l, m 3 |
|
|
Molar සාන්ද්රණය, mol / l |
|
|
විද්යුත් විච්ඡේදක උපාධිය (X), ඒකකයක භාග හෝ % |
|
|
ජලයේ අයනික නිෂ්පාදනය |
කේ(H2O) = |
|
pH අගය |
pH = -lg |
ප්රධාන:
කුස්නෙට්සෝවා එන්.ඊ. සහ ආදිය. රසායන විද්යාව. 8 වන ශ්රේණියේ-10 වන ශ්රේණියේ - M.: Ventana-Graf, 2005-2007.
Kuznetsova N.E., Litvinova T.N., Levkin A.N.රසායන විද්යාව.11 වන ශ්රේණියේ කොටස් 2 කින්, 2005-2007.
Egorov A.S.රසායන විද්යාව. උසස් අධ්යාපනයට සූදානම් වීමට නව පෙළපොතක්. රොස්තොව් n/d: ෆීනික්ස්, 2004.- 640 පි.
Egorov A.S. රසායන විද්යාව: ඒකාබද්ධ රාජ්ය විභාගය සඳහා සූදානම් වීම සඳහා නවීන පාඨමාලාවක්. Rostov n / a: ෆීනික්ස්, 2011. (2012) - 699 පි.
Egorov A.S.රසායනික ගැටළු විසඳීම සඳහා ස්වයං-උපදෙස් අත්පොත. - රොස්තොව්-ඔන්-ඩොන්: ෆීනික්ස්, 2000. - 352 පි.
විශ්ව විද්යාල සඳහා අයදුම්කරුවන් සඳහා රසායන විද්යාව/උපදේශක අත්පොත. Rostov-n/D, Phoenix, 2005- 536 p.
Khomchenko G.P., Khomchenko I.G.. විශ්ව විද්යාල සඳහා අයදුම්කරුවන් සඳහා රසායන විද්යාවේ ගැටළු. එම්.: උසස් පාසල. 2007.-302p.
අතිරේක:
Vrublevsky A.I.. රසායන විද්යාවේ මධ්යගත පරීක්ෂණ සඳහා සූදානම් වීම සඳහා අධ්යාපනික සහ පුහුණු ද්රව්ය / A.I. Vrublevsky -Mn.: Unipress LLC, 2004. - 368 පි.
Vrublevsky A.I.. පාසල් ළමුන් සහ අයදුම්කරුවන් සඳහා පරිවර්තන දාම සහ පාලන පරීක්ෂණ සමඟ රසායන විද්යාවේ ගැටළු 1000 - Mn.: Unipress LLC, 2003. - 400 p.
Egorov A.S.. ඒකාබද්ධ රාජ්ය විභාගය සඳහා සූදානම් වීම සඳහා රසායන විද්යාවෙහි සියලු වර්ගවල ගණනය කිරීමේ ගැටළු - Rostov n / D: Phoenix, 2003. - 320 p.
Egorov A.S., Aminova G.Kh.. රසායන විද්යාව විභාගය සඳහා සූදානම් වීම සඳහා සාමාන්ය කාර්යයන් සහ අභ්යාස. - Rostov n / d: ෆීනික්ස්, 2005. - 448 පි.
ඒකාබද්ධ රාජ්ය විභාගය 2007. රසායන විද්යාව. සිසුන් සූදානම් කිරීම සඳහා අධ්යාපනික සහ පුහුණු ද්රව්ය / FIPI - M.: Intellect-Center, 2007. – 272 p.
ඒකාබද්ධ රාජ්ය විභාගය 2011. රසායන විද්යාව. අධ්යාපනික සහ පුහුණු කට්ටලය. ඒ.ඒ. කවේරිනා - එම්.: ජාතික අධ්යාපනය, 2011.
ඒකාබද්ධ රාජ්ය විභාගය සඳහා සූදානම් වීම සඳහා කාර්යයන් සඳහා එකම සැබෑ විකල්ප. ඒකාබද්ධ රාජ්ය විභාගය 2007. රසායන විද්යාව / V.Yu. මිෂිනා, ඊ.එන්. ස්ට්රෙල්නිකෝවා. එම්.: ෆෙඩරල් පරීක්ෂණ මධ්යස්ථානය, 2007.-151 පි.
කවේරිනා ඒ.ඒ. සිසුන් සූදානම් කිරීම සඳහා කාර්යයේ ප්රශස්ත බැංකුව. ඒකාබද්ධ රාජ්ය විභාගය 2012. රසායන විද්යාව. පෙළපොත./ ඒ.ඒ. Kaverina, D.Yu. ඩොබ්රොටින්, යූ.එන්. මෙඩ්විඩෙව්, එම්.ජී. ස්නාස්ටිනා - එම්.: බුද්ධි-මධ්යස්ථානය, 2012. - 256 පි.
Litvinova T.N., Vyskubova N.K., Azhipa L.T., Solovyova M.V.. මාස 10 ක ලිපි හුවමාරු සූදානම් කිරීමේ පාඨමාලා (ක්රමවේදය උපදෙස්) සිසුන් සඳහා පරීක්ෂණ වලට අමතරව පරීක්ෂණ කාර්යයන්. Krasnodar, 2004. - P. 18 - 70.
ලිට්විනෝවා ටී.එන්.. රසායන විද්යාව. ඒකාබද්ධ රාජ්ය විභාගය 2011. පුහුණු පරීක්ෂණ. රොස්තොව් n/d: ෆීනික්ස්, 2011.- 349 පි.
ලිට්විනෝවා ටී.එන්.. රසායන විද්යාව. ඒකාබද්ධ රාජ්ය විභාගය සඳහා පරීක්ෂණ. Rostov n / d.: ෆීනික්ස්, 2012. - 284 පි.
ලිට්විනෝවා ටී.එන්.. රසායන විද්යාව. නීති, මූලද්රව්යවල ගුණාංග සහ ඒවායේ සංයෝග. Rostov n / d.: ෆීනික්ස්, 2012. - 156 පි.
Litvinova T.N., Melnikova E.D., Solovyova M.V.., Azhipa L.T., Vyskubova N.K.විශ්ව විද්යාල සඳහා අයදුම්කරුවන් සඳහා කාර්යයන්හි රසායන විද්යාව - එම්.: ඔනික්ස් ප්රකාශන හවුස් එල්එල්සී: මිර් සහ අධ්යාපන ප්රකාශන හවුස් එල්එල්සී, 2009. - 832 පි.
වෛද්ය සහ ජීව විද්යාත්මක පන්තිවල සිසුන් සඳහා රසායන විද්යාවේ අධ්යාපනික හා ක්රමවේද සංකීර්ණය, සංස්. ටීඑන් ලිට්විනෝවා - KSMU, - 2008.
රසායන විද්යාව. ඒකාබද්ධ රාජ්ය විභාගය 2008. ප්රවේශ පරීක්ෂණ, ඉගැන්වීම් ආධාර / සංස්. වී.එන්. ඩොරොන්කිනා. - Rostov n / d: Legion, 2008.- 271 p.
රසායන විද්යාව පිළිබඳ වෙබ් අඩවි ලැයිස්තුව:
1. අල්හිමික්. http:// www. alhimik. ru
2. සෑම කෙනෙකුටම රසායන විද්යාව. සම්පූර්ණ රසායන විද්යා පාඨමාලාවක් සඳහා ඉලෙක්ට්රොනික විමර්ශන පොත.
http:// www. තොරතුරු. ru/ පෙළ/ දත්ත සමුදාය/ රසායන විද්යාව/ ආරම්භ කරන්න. html
3. පාසල් රසායන විද්යාව - විමර්ශන පොත. http:// www. පාසල් රසායන විද්යාව. විසින්. ru
4. රසායන විද්යා උපදේශක. http://www. chemistry.nm.ru
අන්තර්ජාල සම්පත්
අල්හිමික්. http:// www. alhimik. ru
සෑම කෙනෙකුටම රසායන විද්යාව. සම්පූර්ණ රසායන විද්යා පාඨමාලාවක් සඳහා ඉලෙක්ට්රොනික විමර්ශන පොත.
http:// www. තොරතුරු. ru/ පෙළ/ දත්ත සමුදාය/ රසායන විද්යාව/ ආරම්භ කරන්න. html
පාසල් රසායන විද්යාව - විමර්ශන පොත. http:// www. පාසල් රසායන විද්යාව. විසින්. ru
http://www.classchem.narod.ru
රසායන විද්යා උපදේශක. http://www. chemistry.nm.ru
http://www.alleng.ru/edu/chem.htm- රසායන විද්යාව පිළිබඳ අධ්යාපනික අන්තර්ජාල සම්පත්
http://schoolchemistry.by.ru/- පාසල් රසායන විද්යාව. මෙම වෙබ් අඩවියට විවිධ මාතෘකා පිළිබඳ මාර්ගගත පරීක්ෂණ මෙන්ම ඒකාබද්ධ රාජ්ය විභාගයේ ආදර්ශන අනුවාද ලබා ගැනීමට අවස්ථාව තිබේ.
රසායන විද්යාව සහ ජීවිතය - XXI සියවස: ජනප්රිය විද්යා සඟරාව. http:// www. hij. ru
පාසල් රසායන විද්යා පාඨමාලාවක් සඳහා මූලික සූත්ර එකතුව
පාසල් රසායන විද්යා පාඨමාලාවක් සඳහා මූලික සූත්ර එකතුව
G. P. Loginova
එලේනා සවින්කිනා
E. V. Savinkina G. P. Loginova
රසායන විද්යාවේ මූලික සූත්ර එකතුව
සිසුන්ගේ පොකට් මාර්ගෝපදේශය
සාමාන්ය රසායන විද්යාව
වඩාත්ම වැදගත් රසායනික සංකල්ප සහ නීති
රසායනික මූලද්රව්යය- මෙය එකම න්යෂ්ටික ආරෝපණයක් සහිත යම් පරමාණුවකි.
සාපේක්ෂ පරමාණුක ස්කන්ධය(A r) පෙන්නුම් කරන්නේ දී ඇති රසායනික මූලද්රව්යයක පරමාණුවක ස්කන්ධය කාබන්-12 පරමාණුවක (12 C) ස්කන්ධයට වඩා කී ගුණයක් වැඩිද යන්නයි.
රසායනික ද්රව්යය- ඕනෑම රසායනික අංශු එකතුවකි.
රසායනික අංශු
සූත්ර ඒකකය- සාම්ප්රදායික අංශුවක්, එහි සංයුතිය ලබා දී ඇති රසායනික සූත්රයට අනුරූප වේ, උදාහරණයක් ලෙස:Ar - ආගන් ද්රව්යය (Ar පරමාණු වලින් සමන්විත වේ),
H 2 O - ද්රව්ය ජලය (H 2 O අණු වලින් සමන්විත වේ),
KNO 3 - පොටෑසියම් නයිට්රේට් ද්රව්යය (K + කැටායන සහ NO 3 ¯ ඇනායන වලින් සමන්විත වේ).
භෞතික ප්රමාණ අතර සබඳතා
මූලද්රව්යයේ පරමාණුක ස්කන්ධය (සාපේක්ෂ). B, A r (B):කොහෙද *ටී(පරමාණු B) - මූලද්රව්ය B හි පරමාණුවක ස්කන්ධය;
*t සහ- පරමාණුක ස්කන්ධ ඒකකය;
*t සහ = 1/12 ටී(12 C පරමාණුව) = 1.6610 24 ග්රෑම්.
ද්රව්ය ප්රමාණය B, n(B), mol:
කොහෙද N(B)- අංශු ගණන B;
එන් ඒ– ඇවගාඩ්රෝ නියතය (N A = 6.0210 23 mol -1).
ද්රව්යයක මවුල ස්කන්ධය V, M(V), g/mol:
කොහෙද රෑපවාහිණි)- ස්කන්ධය බී.
වායුවේ Molar පරිමාවතුල, වී එම් l/mol:
කොහෙද V M = 22.4 l/mol (ඇවගාඩ්රෝ නීතියේ ප්රතිවිපාක), සාමාන්ය තත්ව යටතේ (n.s. - වායුගෝලීය පීඩනය p = 101,325 Pa (1 atm); තාප ගතික උෂ්ණත්වය ටී = 273.15 K හෝ සෙල්සියස් උෂ්ණත්වය t = 0 °C).
බී හයිඩ්රජන් සඳහා, ඩී(ගෑස් බී එච් 2):
*වායුමය ද්රව්යයේ ඝනත්වයතුල ගුවන් මගින්, ඩී(වාතය හරහා වායු බී): මූලද්රව්යයේ ස්කන්ධ භාගයඊ පදාර්ථය තුළ V, w(E):මෙහි x යනු B ද්රව්යයේ සූත්රයේ ඇති E පරමාණු ගණනයි
පරමාණුවේ ව්යුහය සහ ආවර්තිතා නීතිය D.I. මෙන්ඩලීව්
ස්කන්ධ අංකය (A) - පරමාණුක න්යෂ්ටියේ ඇති මුළු ප්රෝටෝන සහ නියුට්රෝන ගණන:
A = N(p 0) + N(p +).
පරමාණුක න්යෂ්ටික ආරෝපණ (Z)න්යෂ්ටියේ ඇති ප්රෝටෝන ගණනට සහ පරමාණුවේ ඇති ඉලෙක්ට්රෝන ගණනට සමාන වේ:Z = N(p+) = N(e¯).
සමස්ථානික- එකම මූලද්රව්යයේ පරමාණු, න්යෂ්ටියේ ඇති නියුට්රෝන ගණනින් වෙනස්, උදාහරණයක් ලෙස: පොටෑසියම්-39: 39 K (19 p + , 20n 0, 19e¯); පොටෑසියම්-40: 40 K (19 p+, 21n 0, 19e¯).*ශක්ති මට්ටම් සහ උප මට්ටම්
*පරමාණුක කක්ෂය(AO) නිශ්චිත ශක්තියක් ඇති ඉලෙක්ට්රෝනයක සම්භාවිතාව විශාලම අවකාශයේ කලාපය සංලක්ෂිත කරයි.*s- සහ p-කක්ෂවල හැඩතල
ආවර්තිතා නීතිය සහ ආවර්තිතා පද්ධතිය D.I. මෙන්ඩලීව්
මූලද්රව්යවල ගුණ සහ ඒවායේ සංයෝග වරින් වර වැඩිවන පරමාණුක ක්රමාංකය සමඟ පුනරාවර්තනය වන අතර එය මූලද්රව්යයේ පරමාණුවේ න්යෂ්ටියේ ආරෝපණයට සමාන වේ.කාල සීමාවඅනුරූප වේ ඉලෙක්ට්රෝන වලින් පිරුණු ශක්ති මට්ටම් ගණන,සහ වෙනුවෙන් පෙනී සිටියි පිරවිය යුතු අවසාන ශක්ති මට්ටම(EU).
කණ්ඩායම් අංකය Aපෙන්වයි සහ ආදිය
කණ්ඩායම් අංක Bපෙන්වයි සංයුජතා ඉලෙක්ට්රෝන ගණන nsසහ (n – 1)d.
S-මූලද්රව්ය අංශය- ශක්ති උප මට්ටම (ESL) ඉලෙක්ට්රෝන වලින් පිරී ඇත ns-EPU- IA- සහ IIA-කණ්ඩායම්, H සහ He.
p-මූලද්රව්ය අංශය- ඉලෙක්ට්රෝන වලින් පිරී ඇත np-EPU- IIIA-VIIIA-කණ්ඩායම්.
D-මූලද්රව්ය අංශය- ඉලෙක්ට්රෝන වලින් පිරී ඇත (P- 1) d-EPU - IB-VIIIB2-කණ්ඩායම්.
f-මූලද්රව්ය අංශය- ඉලෙක්ට්රෝන වලින් පිරී ඇත (පී-2) f-EPU - ලැන්තනයිඩ සහ ඇක්ටිනයිඩ.
ආවර්තිතා වගුවේ 3 වන කාල පරිච්ඡේදයේ මූලද්රව්යවල හයිඩ්රජන් සංයෝගවල සංයුතිය හා ගුණාංගවල වෙනස්කම්
වාෂ්පශීලී නොවන, ජලය සමග දිරාපත් වේ: NaH, MgH 2, AlH 3.වාෂ්පශීලී: SiH 4, PH 3, H 2 S, HCl.
ආවර්තිතා වගුවේ 3 වන කාල පරිච්ඡේදයේ මූලද්රව්යවල ඉහළ ඔක්සයිඩ සහ හයිඩ්රොක්සයිඩවල සංයුතිය හා ගුණාංගවල වෙනස්වීම්
මූලික: Na 2 O – NaOH, MgO – Mg(OH) 2.ඇම්ෆොටරික්: Al 2 O 3 - Al(OH) 3.
ආම්ලික: SiO 2 - H 4 SiO 4, P 2 O 5 - H 3 PO 4, SO 3 - H 2 SO 4, Cl 2 O 7 - HClO 4.
රසායනික බන්ධනය
විද්යුත් සෘණතාව(χ) යනු අණුවක ඇති පරමාණුවකට සෘණ ආරෝපණයක් ලබා ගැනීමේ හැකියාව සංලක්ෂිත ප්රමාණයකි.සහසංයුජ බන්ධන සෑදීමේ යාන්ත්රණ
හුවමාරු යාන්ත්රණය- අසල්වැසි පරමාණුවල කක්ෂ දෙකක අතිච්ඡාදනය, ඒ සෑම එකක්ම එක් ඉලෙක්ට්රෝනයක් විය.පරිත්යාගශීලි-පිළිගැනීමේ යාන්ත්රණය- ඉලෙක්ට්රෝන යුගලයක් අඩංගු තවත් පරමාණුවක කක්ෂයක් සමඟ එක් පරමාණුවක නිදහස් කක්ෂයක අතිච්ඡාදනය වීම.
බන්ධන සෑදීමේදී කක්ෂවල අතිච්ඡාදනය
* දෙමුහුන් කිරීමේ වර්ගය - අංශුවේ ජ්යාමිතික හැඩය - බන්ධන අතර කෝණය
මධ්යම පරමාණු කක්ෂවල දෙමුහුන්කරණය- ඔවුන්ගේ ශක්තිය හා ස්වරූපය පෙළගැස්වීම.sp- රේඛීය - 180 °
sp 2- ත්රිකෝණාකාර - 120 °
sp 3- tetrahedral - 109.5 °
sp 3 d- trigonal-bipyramidal - 90 °; 120°
sp 3 d 2- අෂ්ටක - 90 °
මිශ්රණ සහ විසඳුම්
විසඳුමක්- ද්රව්ය දෙකකින් හෝ වැඩි ගණනකින් සමන්විත සමජාතීය පද්ධතියක්, එහි අන්තර්ගතය යම් සීමාවන් තුළ වෙනස් කළ හැකිය.
විසඳුමක්:ද්රාවකය (උදා. ජලය) + ද්රාවණය.
සැබෑ විසඳුම්නැනෝමීටර 1 ට වඩා කුඩා අංශු අඩංගු වේ.
කොලොයිඩල් විසඳුම්නැනෝමීටර 1 සිට 100 දක්වා ප්රමාණයේ අංශු අඩංගු වේ.
යාන්ත්රික මිශ්රණ(අත්හිටුවීම්) නැනෝමීටර 100 ට වඩා විශාල අංශු අඩංගු වේ.
අත්හිටුවීම=> ඝන + දියර
ඉමල්ෂන්=> දියර + දියර
පෙන, මීදුම=> ගෑස් + දියර
විෂමජාතීය මිශ්රණ වෙන් කරනු ලැබේපදිංචි කිරීම සහ පෙරීම.
සමජාතීය මිශ්රණ වෙන් කරනු ලැබේවාෂ්පීකරණය, ආසවනය, වර්ණදේහය.
සංතෘප්ත විසඳුමද්රාවණය සමඟ සමතුලිතතාවයේ පවතී හෝ විය හැක (ද්රාවණය ඝන නම්, එහි අතිරික්තය අවක්ෂේපය තුළ වේ).
ද්රාව්යතාව- දී ඇති උෂ්ණත්වයකදී සංතෘප්ත ද්රාවණයක විසුරුවා හරින ලද ද්රව්යයේ අන්තර්ගතය.
අසංතෘප්ත විසඳුම අඩු,
අධි සංතෘප්ත ද්රාවණයද්රාවණ අඩංගු වේ තව,දී ඇති උෂ්ණත්වයකදී එහි ද්රාව්යතාවට වඩා.
ද්රාවණයේ භෞතික රසායනික ප්රමාණ අතර සම්බන්ධතා
ද්රාවණයේ ස්කන්ධ භාගයතුල, w(B);ඒකකයක කොටස හෝ %:කොහෙද රෑපවාහිණි)- ස්කන්ධය B,
t(r)- විසඳුමේ ස්කන්ධය.
විසඳුමේ බර, m(p), g:
m(p) = m(B) + m(H 2 O) = V(p) ρ(p),
මෙහි F(p) යනු ද්රාවණයේ පරිමාවයි;ρ (p) - ද්රාවණ ඝනත්වය.
විසඳුමේ පරිමාව, V(p), l:
මවුල සාන්ද්රණය, s(V), mol/l:මෙහි n(B) යනු B ද්රව්ය ප්රමාණයයි;
M(B) - ද්රව්යයේ molar ස්කන්ධය B.
විසඳුමේ සංයුතිය වෙනස් කිරීම
විසඳුම ජලය සමග තනුක කිරීම:> රෑපවාහිණි)= t (B);
> ද්රාවණයේ ස්කන්ධය එකතු කරන ලද ජලයේ ස්කන්ධයෙන් වැඩි වේ: m"(p) = m(p) + m(H 2 O).
විසඳුමකින් ජලය වාෂ්ප කිරීම:
> ද්රාවණයේ ස්කන්ධය වෙනස් නොවේ: t"(B) = t(B).
> ද්රාවණයේ ස්කන්ධය වාෂ්පීකරණය වූ ජලයේ ස්කන්ධයෙන් අඩු වේ. m"(p) = m(p) – m(H 2 O).
විසඳුම් දෙකක් ඒකාබද්ධ කිරීම:ද්රාවණවල ස්කන්ධයන් මෙන්ම ද්රාවිත ද්රව්යයේ ස්කන්ධයන්ද එකතු වේ:
t"(B) = t(B) + t"(B);
t"(p) = t(p) + t"(p).
Crystal drop:ද්රාවණයේ ස්කන්ධය සහ ද්රාවණයේ ස්කන්ධය අවක්ෂේපිත ස්ඵටික ස්කන්ධයෙන් අඩු වේ:
m"(B) = m(B) – m(sediment); m"(p) = m(p) - m(sediment).
ජල ස්කන්ධය වෙනස් නොවේ.
රසායනික ප්රතික්රියාවක තාප බලපෑම
* ΔH ද්රව්යයක් සෑදීමේ එන්තැල්පිය°(B), kJ/mol, යනු සාමාන්ය ද්රව්ය වලින් ද්රව්යයක මවුල 1ක් සෑදීමේ ප්රතික්රියාවේ එන්තැල්පියයි, එනම් නියත පීඩනයකදී (පද්ධතියේ සෑම වායුවක් සඳහාම 1 atm හෝ සම්පූර්ණයෙන් වායුමය ප්රතික්රියා සහභාගිවන්නන් නොමැති විට 1 atm පීඩනය සහ නියත උෂ්ණත්වය (සාමාන්යයෙන් 298 K , හෝ 25 ° C).*රසායනික ප්රතික්රියාවක තාප බලපෑම (හෙස්ගේ නියමය)
Q = ΣQ(නිෂ්පාදන) - ΣQ(ප්රතික්රියාකාරක).
ΔН° = ΣΔН°(නිෂ්පාදන) - Σ ΔН°(ප්රතික්රියාකාරක).
ප්රතික්රියාව සඳහා aA + bB +... = dD + eE +...ΔH° = (dΔH°(D) + eΔH°(E) +…) – (aΔH°(A) + bΔH°(B) +…),
කොහෙද a, b, d, e- ප්රතික්රියා සමීකරණයේ සංගුණකවලට අනුරූප වන ද්රව්යවල ස්ටෝචියෝමිතික ප්රමාණය.රසායනික ප්රතික්රියා අනුපාතය
කාලය තුළ නම් τ පරිමාව වීΔ විසින් වෙනස් කරන ලද ප්රතික්රියාකාරක හෝ නිෂ්පාදන ප්රමාණය n,වේග ප්රතික්රියාව:
ඒක අණුක ප්රතික්රියාවක් සඳහා A → ...:
v = k c(A).
ද්වි අණුක ප්රතික්රියාව සඳහා A + B → ...:v = k c(A) c(B).
ත්රිඅණුක ප්රතික්රියාව සඳහා A + B + C → ...:v = k c(A) c(B) c(C).
රසායනික ප්රතික්රියාවක වේගය වෙනස් කිරීම
වේග ප්රතික්රියාව වැඩි කරන්න:1) රසායනිකව ක්රියාකාරීප්රතික්රියාකාරක;
2) ප්රවර්ධනප්රතික්රියාකාරක සාන්ද්රණය;
3) වැඩි කරන්න
4) ප්රවර්ධනඋෂ්ණත්වය;
5) උත්ප්රේරක.වේග ප්රතික්රියාව අඩු කරන්න:
1) රසායනිකව අක්රියප්රතික්රියාකාරක;
2) පහත හෙලීමප්රතික්රියාකාරක සාන්ද්රණය;
3) අඩු වීමඝන සහ ද්රව ප්රතික්රියාකාරකවල මතුපිට;
4) පහත හෙලීමඋෂ්ණත්වය;
5) නිෂේධක.
*උෂ්ණත්ව වේග සංගුණකය(γ) යනු උෂ්ණත්වය අංශක දහයකින් වැඩි වන විට ප්රතික්රියා වේගය කොපමණ වාර ගණනක් වැඩි වේද යන්න පෙන්වන සංඛ්යාවකට සමාන වේ:
රසායනික සමතුලිතතාවය
*රසායනික සමතුලිතතාවය සඳහා ස්කන්ධ ක්රියාකාරී නීතිය:සමතුලිත තත්වයක, සමාන බලයන්හි නිෂ්පාදනවල මවුල සාන්ද්රණයේ නිෂ්පාදිතයේ අනුපාතය
ඒවායේ ස්ටෝචියෝමිතික සංගුණක, ඒවායේ ස්ටෝචියෝමිතික සංගුණකවලට සමාන බලයන්හි ප්රතික්රියාකාරකවල මවුල සාන්ද්රණයේ ගුණිතයට, නියත උෂ්ණත්වයකදී නියත අගයක් වේ. (සාන්ද්රණ සමතුලිතතා නියතය).
ප්රතිවර්ත කළ හැකි ප්රතික්රියාවක් සඳහා රසායනික සමතුලිතතා තත්ත්වයකදී:
aA + bB + … ↔ dD + fF + ...
K c = [D] d [F] f .../ [A] a [B] b ...
* නිෂ්පාදන සෑදීම දෙසට රසායනික සමතුලිතතාවය මාරු කිරීම
1) ප්රතික්රියාකාරක සාන්ද්රණය වැඩි කිරීම;2) නිෂ්පාදන සාන්ද්රණය අඩු කිරීම;
3) උෂ්ණත්වය ඉහළ යාම (අන්තර්මිතික ප්රතික්රියාවක් සඳහා);
4) උෂ්ණත්වය අඩු වීම (උෂ්ණත්ව ප්රතික්රියාවක් සඳහා);
5) පීඩනය වැඩි වීම (පරිමාවේ අඩු වීමක් සමඟ ඇතිවන ප්රතික්රියාවක් සඳහා);
6) පීඩනය අඩු වීම (පරිමාව වැඩි වීමත් සමඟ ඇතිවන ප්රතික්රියාවක් සඳහා).
විසඳුම තුළ ප්රතික්රියා හුවමාරු කිරීම
විද්යුත් විච්ඡේදනයසමහර ද්රව්ය ජලයේ දියවන විට අයන (කැටායන සහ ඇනායන) සෑදීමේ ක්රියාවලිය.
අම්ලපිහිටුවා ඇත හයිඩ්රජන් කැටායනසහ අම්ල ඇනායන,උදාහරණ වශයෙන්:
HNO 3 = H + + NO 3 ¯
විද්යුත් විච්ඡේදනය අතරතුර හේතුපිහිටුවා ඇත ලෝහ කැටායනසහ හයිඩ්රොක්සයිඩ් අයන, උදාහරණයක් ලෙස:NaOH = Na + + OH¯
විද්යුත් විච්ඡේදනය අතරතුර ලවණ(මධ්යම, ද්විත්ව, මිශ්ර) සෑදී ඇත ලෝහ කැටායනසහ අම්ල ඇනායන, උදාහරණයක් ලෙස:NaNO 3 = Na + + NO 3 ¯
KAl(SO 4) 2 = K + + Al 3+ + 2SO 4 2-
විද්යුත් විච්ඡේදනය අතරතුර අම්ල ලවණපිහිටුවා ඇත ලෝහ කැටායනසහ අම්ල හයිඩ්රෝනියන, උදාහරණයක් ලෙස:NaHCO 3 = Na + + HCO 3 ‾
සමහර ශක්තිමත් අම්ල
HBr, HCl, HClO 4, H 2 Cr 2 O 7, HI, HMnO 4, H 2 SO 4, H 2 SeO 4, HNO 3, H 2 CrO 4ප්රබල හේතු කිහිපයක්
RbOH, CsOH, KOH, NaOH, LiOH, Ba(OH) 2, Sr(OH) 2, Ca(OH) 2විඝටන උපාධිය α- ආරම්භක අංශු ගණනට විඝටනය වූ අංශු ගණනේ අනුපාතය.
නියත පරිමාවකින්:
විඝටනයේ මට්ටම අනුව ද්රව්ය වර්ගීකරණය
බර්තොලට්ගේ නියමය
ද්රාවණයේ හුවමාරු ප්රතික්රියා ආපසු හැරවිය නොහැකි ලෙස සිදු වන්නේ ප්රතිඵලය වන්නේ අවක්ෂේපයක්, වායුවක් හෝ දුර්වල ඉලෙක්ට්රෝලයක සෑදීමයි.අණුක සහ අයනික ප්රතික්රියා සමීකරණ සඳහා උදාහරණ
1. අණුක සමීකරණය: CuCl 2 + 2NaOH = Cu(OH) 2 ↓ + 2NaCl“සම්පූර්ණ” අයනික සමීකරණය: Сu 2+ + 2Сl¯ + 2Na + + 2OH¯ = Cu(OH) 2 ↓ + 2Na + + 2Сl¯
“කෙටි” අයනික සමීකරණය: Cu 2+ + 2OH¯ = Cu(OH) 2 ↓
2. අණුක සමීකරණය: FeS (T) + 2HCl = FeCl 2 + H 2 S
“සම්පූර්ණ” අයනික සමීකරණය: FeS + 2H + + 2Сl¯ = Fe 2+ + 2Сl¯ + H 2 S
“කෙටි” අයනික සමීකරණය: FeS (T) + 2H + = Fe 2+ + H 2 S
3. අණුක සමීකරණය: 3HNO 3 + K 3 PO 4 = H 3 PO 4 + 3KNO 3
"සම්පූර්ණ" අයනික සමීකරණය: 3H + + 3NO 3 ¯ + 3K + + PO 4 3- = H 3 PO 4 + 3K + + 3NO 3 ¯
"කෙටි" අයනික සමීකරණය: 3H + + PO 4 3- = H 3 PO 4
*හයිඩ්රජන් දර්ශකය
(pH) pH = – log = 14 + log*තනුක ජලීය ද්රාවණ සඳහා pH පරාසය
pH 7 (උදාසීන පරිසරය)හුවමාරු ප්රතික්රියා සඳහා උදාහරණ
උදාසීන ප්රතික්රියාව- අම්ලයක් සහ භෂ්මයක් අන්තර්ක්රියා කරන විට සිදුවන හුවමාරු ප්රතික්රියාවකි.1. ක්ෂාර + ශක්තිමත් අම්ලය: Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Ba 2+ + 2ON¯ + 2H + + 2Сl¯ = Ba 2+ + 2Сl¯ + 2N 2 O
H + + OH¯ = H 2 O
2. තරමක් ද්රාව්ය භෂ්ම + ප්රබල අම්ලය: Cu(OH) 2(t) + 2HCl = CuCl 2 + 2H 2 O
Cu(OH) 2 + 2H + + 2Cl¯ = Cu 2+ + 2Cl¯ + 2H 2 O
Cu(OH) 2 + 2H + = Cu 2+ + 2H 2 O
*ජල විච්ඡේදනය- පරමාණුවල ඔක්සිකරණ තත්ත්වයන් වෙනස් නොකර ද්රව්යයක් සහ ජලය අතර හුවමාරු ප්රතික්රියාවක්.
1. ද්විමය සංයෝගවල ආපසු හැරවිය නොහැකි ජල විච්ඡේදනය:
Mg 3 N 2 + 6H 2 O = 3Mg(OH) 2 + 2NH 3
2. ලවණවල ආපසු හැරවිය හැකි ජල විච්ඡේදනය:
A) ලුණු සෑදී ඇත ශක්තිමත් භෂ්ම කැටායනයක් සහ ශක්තිමත් අම්ල ඇනායනයක්:
NaCl = Na + + Сl¯
Na + + H 2 O ≠ ;
Cl¯ + H 2 O ≠
ජල විච්ඡේදනය නොමැත; උදාසීන පරිසරය, pH = 7.
B) ලුණු සෑදී ඇත ශක්තිමත් භෂ්ම කැටායනයක් සහ දුර්වල අම්ල ඇනායනයක්:
Na 2 S = 2Na + + S 2-
Na + + H 2 O ≠
S 2- + H 2 O ↔ HS¯ + OH¯
ඇනායන මගින් ජල විච්ඡේදනය; ක්ෂාරීය පරිසරය, pH>7.
B) ලුණු සෑදී ඇත දුර්වල හෝ තරමක් ද්රාව්ය පදනමක කැටායනයක් සහ ප්රබල අම්ලයක ඇනායනයක්:
හඳුන්වාදීමේ කොටසේ අවසානය.
ලීටර් LLC විසින් සපයන ලද පෙළ.
ඔබට Visa, MasterCard, Maestro බැංකු කාඩ්පතක්, ජංගම දුරකථන ගිණුමකින්, ගෙවීම් පර්යන්තයකින්, MTS හෝ Svyaznoy වෙළඳසැලකින්, PayPal, WebMoney, Yandex.Money, QIWI Wallet, ප්රසාද කාඩ්පත් හෝ හරහා පොත සඳහා ආරක්ෂිතව ගෙවිය හැකිය. ඔබට පහසු තවත් ක්රමයක්.
තොරතුරු පරීක්ෂා කරන්න. මෙම ලිපියේ ඉදිරිපත් කර ඇති තොරතුරුවල කරුණු සහ විශ්වසනීයත්වය පිළිබඳ නිරවද්යතාව පරීක්ෂා කිරීම අවශ්ය වේ. සාකච්ඡා පිටුවේ මාතෘකාව පිළිබඳ සාකච්ඡාවක් ඇත: පාරිභාෂිතය සම්බන්ධයෙන් සැකයන්. රසායනික සූත්රය ... විකිපීඩියාව
රසායනික සූත්රයක් මඟින් රසායනික සංකේත, සංඛ්යා සහ වරහන් බෙදීමේ සංකේත භාවිතා කරන ද්රව්යවල සංයුතිය සහ ව්යුහය පිළිබඳ තොරතුරු පිළිබිඹු කරයි. දැනට, පහත සඳහන් රසායනික සූත්ර වර්ග වෙන්කර හඳුනාගත හැකිය: සරලම සූත්රය. පළපුරුදු ... ... විකිපීඩියාවෙන් ලබා ගත හැක
රසායනික සූත්රයක් මඟින් රසායනික සංකේත, සංඛ්යා සහ වරහන් බෙදීමේ සංකේත භාවිතා කරන ද්රව්යවල සංයුතිය සහ ව්යුහය පිළිබඳ තොරතුරු පිළිබිඹු කරයි. දැනට, පහත සඳහන් රසායනික සූත්ර වර්ග වෙන්කර හඳුනාගත හැකිය: සරලම සූත්රය. පළපුරුදු ... ... විකිපීඩියාවෙන් ලබා ගත හැක
රසායනික සූත්රයක් මඟින් රසායනික සංකේත, සංඛ්යා සහ වරහන් බෙදීමේ සංකේත භාවිතා කරන ද්රව්යවල සංයුතිය සහ ව්යුහය පිළිබඳ තොරතුරු පිළිබිඹු කරයි. දැනට, පහත සඳහන් රසායනික සූත්ර වර්ග වෙන්කර හඳුනාගත හැකිය: සරලම සූත්රය. පළපුරුදු ... ... විකිපීඩියාවෙන් ලබා ගත හැක
රසායනික සූත්රයක් මඟින් රසායනික සංකේත, සංඛ්යා සහ වරහන් බෙදීමේ සංකේත භාවිතා කරන ද්රව්යවල සංයුතිය සහ ව්යුහය පිළිබඳ තොරතුරු පිළිබිඹු කරයි. දැනට, පහත සඳහන් රසායනික සූත්ර වර්ග වෙන්කර හඳුනාගත හැකිය: සරලම සූත්රය. පළපුරුදු ... ... විකිපීඩියාවෙන් ලබා ගත හැක
ප්රධාන ලිපිය: අකාබනික සංයෝග මූලද්රව්ය අනුව අකාබනික සංයෝග ලැයිස්තුව එක් එක් ද්රව්ය සඳහා අකාරාදී පිළිවෙලට (සූත්රය අනුව) ඉදිරිපත් කර ඇති අකාබනික සංයෝගවල තොරතුරු ලැයිස්තුව, මූලද්රව්යවල හයිඩ්රජන් අම්ල (නම් ... ... විකිපීඩියා)
මෙම ලිපිය හෝ කොටස සංශෝධනය කිරීම අවශ්ය වේ. කරුණාකර ලිපි ලිවීමේ නීති රීති වලට අනුකූලව ලිපිය වැඩි දියුණු කරන්න... විකිපීඩියා
රසායනික සමීකරණයක් (රසායනික ප්රතික්රියාවක සමීකරණය) යනු රසායනික සූත්ර, සංඛ්යාත්මක සංගුණක සහ ගණිතමය සංකේත භාවිතයෙන් රසායනික ප්රතික්රියාවක සාම්ප්රදායික නිරූපණයකි. රසායනික ප්රතික්රියාවක සමීකරණය ගුණාත්මක හා ප්රමාණාත්මක... ... විකිපීඩියාව ලබා දෙයි
රසායනික මෘදුකාංග යනු රසායන විද්යා ක්ෂේත්රයේ භාවිතා වන පරිගණක වැඩසටහන් වේ. අන්තර්ගතය 1 රසායනික සංස්කාරකවරුන් 2 වේදිකා 3 සාහිත්යය ... විකිපීඩියාව
පොත්
- කාර්මික උපකරණ ස්ථාපනය කිරීම සඳහා ජපන්-ඉංග්රීසි-රුසියානු ශබ්දකෝෂය. 8,000 ක් පමණ වන, Popova I.S ශබ්දකෝෂය පුළුල් පරාසයක භාවිතා කරන්නන් සඳහා සහ මූලික වශයෙන් ජපානයෙන් කාර්මික උපකරණ සැපයීම සහ ක්රියාත්මක කිරීම සම්බන්ධ පරිවර්තකයන් සහ තාක්ෂණික විශේෂඥයින් සඳහා අදහස් කෙරේ.
- ජෛව රසායනික පද පිළිබඳ කෙටි ශබ්ද කෝෂයක්, Kunizhev S.M.. ශබ්දකෝෂය සාමාන්ය ජෛව රසායන විද්යාව, පරිසර විද්යාව සහ ජෛව තාක්ෂණයේ මූලධර්ම පිළිබඳ පා course මාලාවක් හදාරන විශ්ව විද්යාලවල රසායනික හා ජීව විද්යාත්මක විශේෂතා හදාරන සිසුන් සඳහා අදහස් කරන අතර එය ද භාවිතා කළ හැකිය ...
මූලික සංකල්ප සහ සූත්ර කිහිපයක්.
සියලුම ද්රව්ය විවිධ ස්කන්ධය, ඝනත්වය සහ පරිමාව ඇත. එක් මූලද්රව්යයක ලෝහ කැබැල්ලක් තවත් ලෝහයක හරියටම සමාන ප්රමාණයේ කැබැල්ලකට වඩා බොහෝ ගුණයකින් බර විය හැක.
මවුලය(මවුලු ගණන)
තනතුර: මවුලය, අන්තර්ජාතික: mol- ද්රව්යයක ප්රමාණය සඳහා මිනුම් ඒකකයක්. අඩංගු ද්රව්ය ප්රමාණයට අනුරූප වේ එන්.ඒ.අංශු (අණු, පරමාණු, අයන) එබැවින් විශ්වීය ප්රමාණයක් හඳුන්වා දෙන ලදී - මවුල ගණන.කර්තව්යයන්හිදී නිතර හමුවන වාක්ය ඛණ්ඩයක් වන්නේ “ලැබුණු... ද්රව්ය මවුලය"
එන්.ඒ.= 6.02 1023
එන්.ඒ.- ඇවගාඩ්රෝගේ අංකය. එසේම "ගිවිසුම අනුව අංකයක්." පැන්සලක තුඩක පරමාණු කීයක් තිබේද? දහසක් පමණ. එවැනි ප්රමාණවලින් ක්රියා කිරීම පහසු නැත. එබැවින්, ලොව පුරා සිටින රසායනඥයින් සහ භෞතික විද්යාඥයින් එකඟ විය - අපි අංශු 6.02 × 1023 (පරමාණු, අණු, අයන) ලෙස නම් කරමු. 1 මවුලයක් ද්රව්ය.
1 මවුලය = 6.02 1023 අංශු
ගැටළු විසඳීම සඳහා වූ මූලික සූත්රවලින් පළමුවැන්න මෙයයි.
ද්රව්යයක මවුල ස්කන්ධය
යනු මවුලික ස්කන්ධයපදාර්ථය යනු එකක ස්කන්ධයයි ද්රව්යයේ මවුලය.
Mr ලෙස දැක්වේ. එය ආවර්තිතා වගුව අනුව සොයා ගැනේ - එය හුදෙක් ද්රව්යයක පරමාණුක ස්කන්ධ එකතුවකි.
උදාහරණයක් ලෙස, අපට සල්ෆියුරික් අම්ලය ලබා දී ඇත - H2SO4. ද්රව්යයක මවුල ස්කන්ධය ගණනය කරමු: පරමාණුක ස්කන්ධය H = 1, S-32, O-16.
Mr(H2SO4)=1 2+32+16 4=98 g\mol.
ගැටළු විසඳීම සඳහා අවශ්ය දෙවන සූත්රය වේ
ද්රව්ය ස්කන්ධ සූත්රය:
එනම්, ද්රව්යයක ස්කන්ධය සොයා ගැනීම සඳහා, ඔබ මවුල (n) සංඛ්යාව දැන සිටිය යුතු අතර, අපි ආවර්තිතා වගුවෙන් මවුල ස්කන්ධය සොයා ගනිමු.
ස්කන්ධ සංරක්ෂණ නීතිය -රසායනික ප්රතික්රියාවකට ඇතුළු වන ද්රව්යවල ස්කන්ධය සෑම විටම එහි ප්රතිඵලයක් ලෙස ලැබෙන ද්රව්යවල ස්කන්ධයට සමාන වේ.
ප්රතික්රියා කළ ද්රව්යවල ස්කන්ධය (es) අපි දන්නේ නම්, එම ප්රතික්රියාවේ නිෂ්පාදනවල ස්කන්ධය (es) අපට සොයාගත හැකිය. සහ අනෙක් අතට.
රසායන විද්යා ගැටළු විසඳීම සඳහා තුන්වන සූත්රය වේ
ද්රව්යයේ පරිමාව:
සමාවන්න, මෙම රූපය අපගේ මාර්ගෝපදේශ සපුරාලන්නේ නැත. ප්රකාශනය දිගටම කරගෙන යාමට, කරුණාකර පින්තූරය මකන්න හෝ වෙනත් එකක් උඩුගත කරන්න.අංක 22.4 පැමිණියේ කොහෙන්ද? සිට ඇවගාඩ්රෝ නීතිය:
එකම උෂ්ණත්වයේ සහ පීඩනයේ දී ගන්නා ලද විවිධ වායූන්ගේ සමාන පරිමාවක එකම අණු ගණන අඩංගු වේ.
ඇවගාඩ්රෝගේ නියමයට අනුව සාමාන්ය තත්ත්වයේ (n.s.) පරමාදර්ශී වායුවක මවුලයක් එකම පරිමාවක් ඇත. Vm= 22.413 996(39) l
එනම්, ගැටලුවේ දී අපට සාමාන්ය තත්වයන් ලබා දී ඇත්නම්, මවුල (n) සංඛ්යාව දැන ගැනීමෙන්, ද්රව්යයේ පරිමාව සොයාගත හැකිය.
ඒ නිසා, ගැටළු විසඳීම සඳහා මූලික සූත්රරසායන විද්යාව තුළ
ඇවගාඩ්රෝගේ අංකයඑන්.ඒ.
6.02 1023 අංශු
ද්රව්ය ප්රමාණය n (mol)
n=V\22.4 (l\mol)
ද්රව්යයේ ස්කන්ධය m (g)
ද්රව්යයේ පරිමාව V(එල්)
V=n 22.4 (l\mol)
සමාවන්න, මෙම රූපය අපගේ මාර්ගෝපදේශ සපුරාලන්නේ නැත. ප්රකාශනය දිගටම කරගෙන යාමට, කරුණාකර පින්තූරය මකන්න හෝ වෙනත් එකක් උඩුගත කරන්න.මේවා සූත්ර. බොහෝ විට, ගැටළු විසඳීම සඳහා, ඔබ මුලින්ම ප්රතික්රියා සමීකරණය ලිවිය යුතු අතර (අවශ්ය!) සංගුණක සකස් කරන්න - ඔවුන්ගේ අනුපාතය ක්රියාවලිය තුළ මවුල අනුපාතය තීරණය කරයි.
ප්රධාන වචන: රසායන විද්යාව 8 වන ශ්රේණිය. සියලුම සූත්ර සහ නිර්වචන, භෞතික ප්රමාණවල සංකේත, මිනුම් ඒකක, මිනුම් ඒකක නම් කිරීම සඳහා උපසර්ග, ඒකක අතර සම්බන්ධතා, රසායනික සූත්ර, මූලික අර්ථ දැක්වීම්, කෙටියෙන්, වගු, රූප සටහන්.
1. සංකේත, නම් සහ මිනුම් ඒකක
රසායන විද්යාවේ භාවිතා වන සමහර භෞතික ප්රමාණ
| භෞතික ප්රමාණය | තනතුරු | ඒකකය |
| කාලය | ටී | සමග |
| පීඩනය | පි | Pa, kPa |
| ද්රව්ය ප්රමාණය | ν | මවුලය |
| ද්රව්යයේ ස්කන්ධය | එම් | kg, g |
| ස්කන්ධ භාගය | ω | මාන රහිත |
| යනු මවුලික ස්කන්ධය | එම් | kg / mol, g / mol |
| Molar පරිමාව | Vn | m 3 / mol, l / mol |
| ද්රව්යයේ පරිමාව | වී | m 3, l |
| පරිමාව කොටස | මාන රහිත | |
| සාපේක්ෂ පරමාණුක ස්කන්ධය | ඒ ආර් | මාන රහිත |
| මහතා | මාන රහිත | |
| A වායුවේ සාපේක්ෂ ඝනත්වය B වායුව | ඩී B (A) | මාන රහිත |
| පදාර්ථයේ ඝනත්වය | ආර් | kg/m 3, g/cm 3, g/ml |
| ඇවගාඩ්රෝ නියතය | එන් ඒ | 1/mol |
| නිරපේක්ෂ උෂ්ණත්වය | ටී | කේ (කෙල්වින්) |
| උෂ්ණත්වය සෙල්සියස් | ටී | °C (සෙල්සියස් අංශක) |
| රසායනික ප්රතික්රියාවක තාප බලපෑම | ප්රශ්නය | kJ/mol |

2. භෞතික ප්රමාණ ඒකක අතර සම්බන්ධතා

3. 8 වන ශ්රේණියේ රසායනික සූත්ර
4. 8 වන ශ්රේණියේ මූලික නිර්වචන

- පරමාණුව- ද්රව්යයක කුඩාම රසායනිකව බෙදිය නොහැකි අංශුව.
- රසායනික මූලද්රව්යය- යම් ආකාරයක පරමාණුවක්.
- අණුව- එහි සංයුතිය හා රසායනික ගුණාංග රඳවා තබා ගන්නා සහ පරමාණු වලින් සමන්විත ද්රව්යයක කුඩාම අංශුව.
- සරල ද්රව්ය- අණු එකම වර්ගයේ පරමාණු වලින් සමන්විත ද්රව්ය.
- සංකීර්ණ ද්රව්ය- විවිධ වර්ගවල පරමාණු වලින් සමන්විත අණු අඩංගු ද්රව්ය.
- ද්රව්යයේ ගුණාත්මක සංයුතිය එය සමන්විත වන්නේ කුමන මූලද්රව්ය පරමාණුවලින්ද යන්න පෙන්වයි.
- ද්රව්යයේ ප්රමාණාත්මක සංයුතිය එහි සංයුතියේ එක් එක් මූලද්රව්යයේ පරමාණු සංඛ්යාව පෙන්වයි.
- රසායනික සූත්රය- රසායනික සංකේත සහ දර්ශක භාවිතා කරමින් ද්රව්යයක ගුණාත්මක හා ප්රමාණාත්මක සංයුතිය සාම්ප්රදායික පටිගත කිරීම.
- පරමාණුක ස්කන්ධ ඒකකය(amu) - පරමාණුක ස්කන්ධය මැනීමේ ඒකකයක්, කාබන් පරමාණු 12 C 1/12 ස්කන්ධයට සමාන වේ.
- මවුලය- කාබන් 12 C කිලෝ ග්රෑම් 0.012 ක පරමාණු ගණනට සමාන අංශු ගණනාවක් අඩංගු ද්රව්යයක ප්රමාණය.
- ඇවගාඩ්රෝ නියතය (නා = 6*10 23 mol -1) - එක් මවුලයක අඩංගු අංශු ගණන.
- ද්රව්යයක මවුල ස්කන්ධය (එම් ) යනු මවුල 1ක ප්රමාණයකින් ගන්නා ද්රව්යයක ස්කන්ධයයි.
- සාපේක්ෂ පරමාණුක ස්කන්ධයමූලද්රව්යය ඒ ආර් - දී ඇති මූලද්රව්යයක පරමාණුවක ස්කන්ධයේ අනුපාතය කාබන් පරමාණුවක ස්කන්ධයෙන් m 0 සිට 1/12 දක්වා 12 C.
- සාපේක්ෂ අණුක බරද්රව්ය එම් ආර් - දී ඇති ද්රව්යයක අණුවක ස්කන්ධයේ අනුපාතය කාබන් පරමාණුවක ස්කන්ධයෙන් 1/12 ට 12 C. සාපේක්ෂ අණුක ස්කන්ධය සංයෝගය සාදන රසායනික මූලද්රව්යවල සාපේක්ෂ පරමාණුක ස්කන්ධවල එකතුවට සමාන වේ. දී ඇති මූලද්රව්යයක පරමාණු ගණන සැලකිල්ලට ගනී.
- ස්කන්ධ භාගයරසායනික මූලද්රව්යය ω(X)දී ඇති මූලද්රව්යයක් මගින් X ද්රව්යයේ සාපේක්ෂ අණුක ස්කන්ධයෙන් කුමන කොටස ගණනය කරන්නේද යන්න පෙන්වයි.
පරමාණුක-අණුක ඉගැන්වීම
1. අණුක සහ අණුක නොවන ව්යුහය සහිත ද්රව්ය ඇත.
2. අණු අතර හිඩැස් ඇති අතර, ඒවායේ ප්රමාණයන් ද්රව්යයේ එකතු කිරීමේ තත්වය සහ උෂ්ණත්වය මත රඳා පවතී.
3. අණු අඛණ්ඩ චලිතයක පවතී.
4. අණු සෑදී ඇත්තේ පරමාණු වලින්.
6. පරමාණු යම් ස්කන්ධයකින් සහ ප්රමාණයකින් සංලක්ෂිත වේ.
භෞතික සංසිද්ධි අතරතුර, රසායනික සංසිද්ධි වලදී අණු සංරක්ෂණය කර ඇත, රීතියක් ලෙස, ඒවා විනාශ වේ. රසායනික සංසිද්ධිවලදී පරමාණු නැවත සකස් වී නව ද්රව්යවල අණු සාදයි.

පදාර්ථයේ නියත සංයුතිය පිළිබඳ නීතිය
සකස් කිරීමේ ක්රමය කුමක් වුවත්, අණුක ව්යුහයේ සෑම රසායනිකව පිරිසිදු ද්රව්යයක්ම නියත ගුණාත්මක හා ප්රමාණාත්මක සංයුතියක් ඇත.
VALENCE
Valency යනු රසායනික මූලද්රව්යයක පරමාණුවක වෙනත් මූලද්රව්යයක නිශ්චිත පරමාණු සංඛ්යාවක් සම්බන්ධ කිරීමට හෝ ප්රතිස්ථාපනය කිරීමට ඇති ගුණාංගයයි.

රසායනික ප්රතික්රියාව
රසායනික ප්රතික්රියාවක් යනු එක් ද්රව්යයකින් වෙනත් ද්රව්ය සෑදෙන ප්රපංචයකි. ප්රතික්රියාකාරක යනු රසායනික ප්රතික්රියාවකට ඇතුල් වන ද්රව්යයන්ය. ප්රතික්රියා නිෂ්පාදන යනු ප්රතික්රියාවක ප්රතිඵලයක් ලෙස සෑදෙන ද්රව්ය වේ.
රසායනික ප්රතික්රියා වල සංඥා:
1. තාපය (ආලෝකය) මුදා හැරීම.
2. වර්ණය වෙනස් කිරීම.
3. සුවඳ පෙනේ.
4. අවසාදිත සෑදීම.
5. ගෑස් මුදා හැරීම.




 වී එම්= 22.4 l/mol (n.s.)
වී එම්= 22.4 l/mol (n.s.)