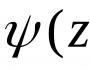Nh3 kimyəvi bağ növüdür. NH3 maddəsinin xassələri və adı nədir? Ammonyakın kimyəvi xassələri
|
Bu mövzunu öyrənmək nəticəsində siz öyrənəcəksiniz:
Bu mövzunu öyrənmək nəticəsində siz öyrənəcəksiniz:
Tədris sualları: |
5.1. Kovalent bağ
Kimyəvi bağ iki və ya daha çox atom bir araya gəldikdə, onların qarşılıqlı təsiri nəticəsində sistemin ümumi enerjisi azaldıqda yaranır. Atomların xarici elektron qabıqlarının ən sabit elektron konfiqurasiyaları iki və ya səkkiz elektrondan ibarət nəcib qaz atomlarının konfiqurasiyasıdır. Digər elementlərin atomlarının xarici elektron qabıqları birdən yeddiyə qədər elektron ehtiva edir, yəni. yarımçıq qalırlar. Bir molekul əmələ gəldikdə, atomlar sabit iki elektron və ya səkkiz elektron qabığı əldə etməyə meyllidirlər. Atomların valent elektronları kimyəvi bağın yaranmasında iştirak edir.
Kovalent, bu iki atoma eyni vaxtda aid olan elektron cütləri tərəfindən əmələ gələn iki atom arasındakı kimyəvi bağdır.
Kovalent bağların yaranmasının iki mexanizmi var: mübadilə və donor-akseptor.
5.1.1. Kovalent rabitənin əmələ gəlməsinin mübadilə mexanizmi
Mübadilə mexanizmi Kovalent bağın əmələ gəlməsi müxtəlif atomlara aid elektronların elektron buludlarının üst-üstə düşməsi nəticəsində həyata keçirilir. Məsələn, iki hidrogen atomu bir-birinə yaxınlaşdıqda, 1s elektron orbitalları üst-üstə düşür. Nəticədə, eyni vaxtda hər iki atoma aid olan ümumi elektron cütü meydana çıxır. Bu halda, kimyəvi bağ antiparalel spinləri olan elektronlar tərəfindən əmələ gəlir, Şəkil 2. 5.1.
düyü. 5.1. İki H atomundan hidrogen molekulunun əmələ gəlməsi
5.1.2. Kovalent bağların əmələ gəlməsi üçün donor-akseptor mexanizmi
Kovalent bağ əmələ gəlməsinin donor-akseptor mexanizmi ilə əlaqə elektron cütlərindən istifadə etməklə də yaranır. Lakin bu zaman bir atom (donor) öz elektron cütünü təmin edir, digər atom (akseptor) isə sərbəst orbitalı ilə əlaqənin yaranmasında iştirak edir. Donor-akseptor bağının həyata keçirilməsinə misal olaraq ammonyak NH 3-ün hidrogen kationu H+ ilə qarşılıqlı təsiri zamanı ammonium ionu NH 4+ əmələ gəlməsini göstərmək olar.
NH 3 molekulunda üç elektron cütü üç N – H rabitəsi əmələ gətirir, azot atomuna aid dördüncü elektron cütü təkdir. Bu elektron cütü boş orbital olan hidrogen ionu ilə əlaqə yarada bilər. Nəticə ammonium ionu NH 4 +, Şəkil 2. 5.2.

düyü. 5.2. Ammonium ionunun əmələ gəlməsi zamanı donor-akseptor bağının görünüşü
Qeyd etmək lazımdır ki, NH 4 + ionunda mövcud olan dörd kovalent N–H bağı ekvivalentdir. Ammonium ionunda donor-akseptor mexanizmi ilə əmələ gələn bağı müəyyən etmək mümkün deyil.
5.1.3. Qütblü və qeyri-qütblü kovalent rabitə
Kovalent bağ eyni atomlar tərəfindən əmələ gəlirsə, elektron cütü bu atomların nüvələri arasında eyni məsafədə yerləşir. Belə bir kovalent rabitə qeyri-qütblü adlanır. Qeyri-qütblü kovalent əlaqəyə malik molekullara misal olaraq H2, Cl2, O2, N2 və s.
Qütb kovalent rabitə vəziyyətində ortaq elektron cütü daha yüksək elektronmənfiliyi olan atoma keçir. Bu növ bağ müxtəlif atomların əmələ gətirdiyi molekullarda həyata keçirilir. Qütb kovalent bağ HCl, HBr, CO, NO və s. molekullarında baş verir. Məsələn, HCl molekulunda qütb kovalent bağın əmələ gəlməsi diaqramla göstərilə bilər, Şəkil 1. 5.3:

düyü. 5.3. HC1 molekulunda kovalent qütb bağının əmələ gəlməsi
Baxılan molekulda elektron cütü xlor atomuna keçir, çünki onun elektronmənfiliyi (2.83) hidrogen atomunun elektronmənfiliyindən (2.1) böyükdür.
5.1.4. Dipol momenti və molekulyar quruluş
Bağın polaritesinin ölçüsü onun dipol momenti μ-dir:
μ = e l,
Harada e- elektron yükü, l– müsbət və mənfi yüklərin mərkəzləri arasındakı məsafə.
Dipol momenti vektor kəmiyyətidir. “Bağ dipol momenti” və “molekulun dipol momenti” anlayışları yalnız iki atomlu molekullar üçün üst-üstə düşür. Molekulun dipol momenti bütün bağların dipol anlarının vektor cəminə bərabərdir. Beləliklə, çox atomlu molekulun dipol momenti onun quruluşundan asılıdır.
Xətti CO 2 molekulunda, məsələn, C-O bağlarının hər biri qütbdür. Bununla belə, CO 2 molekulu ümumiyyətlə qeyri-qütbdür, çünki bağların dipol momentləri bir-birini ləğv edir (şək. 5.4). Karbon qazı molekulunun dipol momenti m = 0-dır.
Bucaq H2O molekulunda qütb H–O bağları 104,5 o bucaq altında yerləşir. İki H–O rabitəsinin dipol momentlərinin vektor cəmi paraleloqramın diaqonalı ilə ifadə edilir (şək. 5.4). Nəticədə su molekulunun dipol momenti m sıfıra bərabər deyil.

düyü. 5.4. CO 2 və H 2 O molekullarının dipol momentləri
5.1.5. Kovalent rabitəli birləşmələrdə elementlərin valentliyi
Atomların valentliyi digər atomların elektronları ilə ümumi elektron cütlərinin əmələ gəlməsində iştirak edən qoşalaşmamış elektronların sayı ilə müəyyən edilir. Xarici elektron təbəqəsində bir qoşalaşmamış elektrona malik olan F 2, HCl, PBr 3 və CCl 4 molekullarındakı halogen atomları monovalentdir. Oksigen alt qrupunun elementləri xarici təbəqədə iki qoşalaşmamış elektrondan ibarətdir, buna görə də O 2, H 2 O, H 2 S və SCl 2 kimi birləşmələrdə onlar ikivalentdirlər.
Molekullarda adi kovalent bağlarla yanaşı, donor-akseptor mexanizmi ilə də rabitə yarana bildiyi üçün atomların valentliyi də tək elektron cütlərinin və sərbəst elektron orbitallarının mövcudluğundan asılıdır. Valentliyin kəmiyyət ölçüsü müəyyən bir atomun digər atomlarla bağlandığı kimyəvi bağların sayıdır.
Elementlərin maksimum valentliyi, bir qayda olaraq, onların yerləşdiyi qrupun sayından çox ola bilməz. İstisna birləşmələrdə valentliyi birdən çox olan birinci qrupun ikinci dərəcəli alt qrupunun Cu, Ag, Au elementləridir. Valentlik elektronlarına ilk növbədə xarici təbəqələrin elektronları daxildir, lakin yan alt qrupların elementləri üçün sondan əvvəlki (xarici) təbəqələrin elektronları da kimyəvi bağın yaranmasında iştirak edir.
5.1.6. Normal və həyəcanlı vəziyyətdə elementlərin valentliyi
Əksər kimyəvi elementlərin valentliyi bu elementlərin normal və ya həyəcanlı vəziyyətdə olmasından asılıdır. Li atomunun elektron konfiqurasiyası: 1s 2 2s 1. Xarici səviyyədəki litium atomu bir qoşalaşmamış elektrona malikdir, yəni. litium monovalentdir. Üçvalentli litium əldə etmək üçün 1s elektronunun 2p orbitalına keçidi ilə bağlı çox böyük enerji sərfi tələb olunur. Bu enerji xərci o qədər böyükdür ki, kimyəvi bağların əmələ gəlməsi zamanı ayrılan enerji ilə kompensasiya olunmur. Bu baxımdan, üçvalentli litium birləşmələri yoxdur.
Berilyum altqrupunun elementlərinin xarici elektron təbəqəsinin konfiqurasiyası ns 2. Bu o deməkdir ki, ns hüceyrə orbitalında bu elementlərin xarici elektron təbəqəsində əks spinli iki elektron var. Berilyum yarımqrupunun elementlərində qoşalaşmamış elektronlar yoxdur, ona görə də onların normal vəziyyətdə valentliyi sıfırdır. Həyəcanlı vəziyyətdə berilyum alt qrupunun elementlərinin elektron konfiqurasiyası ns 1 nр 1, yəni. elementlər ikivalent olduqları birləşmələr əmələ gətirirlər.
Bor atomunun valentlik imkanları
Bor atomunun əsas vəziyyətdə elektron konfiqurasiyasını nəzərdən keçirək: 1s 2 2s 2 2p 1. Əsas vəziyyətdə olan bor atomu bir qoşalaşmamış elektrondan ibarətdir (şək. 5.5), yəni. monovalentdir. Bununla belə, bor monovalent olduğu birləşmələrin əmələ gəlməsi ilə xarakterizə edilmir. Bor atomu həyəcanlandıqda bir 2s elektron 2p orbitala keçir (şək. 5.5). Həyəcanlı vəziyyətdə olan bir bor atomunun 3 qoşalaşmamış elektronu var və valentliyi üç olan birləşmələr yarada bilər.

düyü. 5.5. Normal və həyəcanlı vəziyyətlərdə bor atomunun valentlik halları
Bir enerji səviyyəsi daxilində bir atomun həyəcanlanmış vəziyyətə keçməsinə sərf olunan enerji, bir qayda olaraq, əlavə bağların formalaşması zamanı ayrılan enerji ilə kompensasiya olunur.
Bor atomunda bir sərbəst 2p orbitalın olması səbəbindən birləşmələrdə bor, elektron cütünün qəbuledicisi kimi fəaliyyət göstərən dördüncü kovalent rabitə yarada bilər. Şəkil 5.6-da BF molekulunun F – ionu ilə qarşılıqlı əlaqəsi, nəticədə borun dörd kovalent bağ əmələ gətirdiyi – ionunun əmələ gəlməsi göstərilir.

düyü. 5.6. Bor atomunda dördüncü kovalent rabitənin əmələ gəlməsi üçün donor-akseptor mexanizmi
Azot atomunun valentlik imkanları
Azot atomunun elektron quruluşunu nəzərdən keçirək (şək. 5.7).

düyü. 5.7. Azot atomunun orbitallarında elektronların paylanması
Təqdim olunan diaqramdan aydın olur ki, azotun üç qoşalaşmamış elektronu var, üç kimyəvi bağ yarada bilər və valentliyi üçdür. Azot atomunun həyəcanlı vəziyyətə keçməsi qeyri-mümkündür, çünki ikinci enerji səviyyəsində d-orbitallar yoxdur. Eyni zamanda, azot atomu sərbəst orbital (qəbuledici) olan bir atoma xarici elektronların 2s 2 tək elektron cütünü təmin edə bilər. Nəticədə, məsələn, ammonium ionunda olduğu kimi, azot atomunun dördüncü kimyəvi bağı meydana çıxır (şək. 5.2). Beləliklə, bir azot atomunun maksimum kovalentliyi (yaradılan kovalent bağların sayı) dörddür. Onun birləşmələrində azot, beşinci qrupun digər elementlərindən fərqli olaraq, beşvalent ola bilməz.
Fosfor, kükürd və halogen atomlarının valentlik imkanları
Azot, oksigen və flüor atomlarından fərqli olaraq, üçüncü dövrdə yerləşən fosfor, kükürd və xlor atomları elektronların keçə biləcəyi sərbəst 3d hüceyrələrə malikdir. Fosfor atomu həyəcanlandıqda (şək. 5.8) onun xarici elektron təbəqəsində 5 qoşalaşmamış elektron olur. Nəticədə birləşmələrdə fosfor atomu təkcə üç yox, həm də beşvalent ola bilər.

düyü. 5.8. Həyəcanlı vəziyyətdə olan fosfor atomu üçün valent elektronların orbitallarda paylanması
Həyəcanlı vəziyyətdə kükürd, iki valentliyə əlavə olaraq, dörd və altı valentlik də nümayiş etdirir. Bu zaman 3p və 3s elektronları ardıcıl olaraq qoşalaşırlar (şək. 5.9).


düyü. 5.9. Həyəcanlı vəziyyətdə kükürd atomunun valentlik imkanları
Həyəcanlı vəziyyətdə, flüor istisna olmaqla, V qrupun əsas alt qrupunun bütün elementləri üçün əvvəlcə p-, sonra isə s-elektron cütlərinin ardıcıl cütləşməsi mümkündür. Nəticədə bu elementlər üç, beş və yeddivalent olurlar (şək. 5.10).



düyü. 5.10. Həyəcanlı vəziyyətdə xlor, brom və yod atomlarının valentlik imkanları
5.1.7. Kovalent rabitənin uzunluğu, enerjisi və istiqaməti
Kovalent bağlar adətən qeyri-metal atomları arasında yaranır. Kovalent bağın əsas xüsusiyyətləri uzunluq, enerji və istiqamətdir.
Kovalent bağ uzunluğu
Bağın uzunluğu bu bağı meydana gətirən atomların nüvələri arasındakı məsafədir. Eksperimental fiziki üsullarla müəyyən edilir. Bağın uzunluğu AB molekulundakı bağ uzunluğu A 2 və B 2 molekullarındakı bağ uzunluqlarının cəminin təxminən yarısına bərabər olan əlavəlik qaydasından istifadə etməklə hesablana bilər:
 .
.
Elementlərin dövri sisteminin altqrupları boyunca yuxarıdan aşağıya doğru kimyəvi bağın uzunluğu artır, çünki atomların radiusları bu istiqamətdə artır (cədvəl 5.1). Bağın çoxluğu artdıqca uzunluğu azalır.
Cədvəl 5.1.
Bəzi kimyəvi bağların uzunluğu
Kimyəvi bağ |
Link uzunluğu, pm |
Kimyəvi bağ |
Link uzunluğu, pm |
C - C |
|||
Rabitə enerjisi
Bağın gücünün ölçüsü bağ enerjisidir. Rabitə enerjisi bir əlaqəni qırmaq və bu bağı meydana gətirən atomları bir-birindən sonsuz böyük məsafəyə çıxarmaq üçün lazım olan enerji ilə müəyyən edilir. Kovalent bağ çox güclüdür. Onun enerjisi bir neçə onlarla ilə bir neçə yüz kJ/mol arasında dəyişir. Məsələn, IСl 3 molekulu üçün Ebond ≈40, N 2 və CO molekulları üçün Ebond ≈1000 kJ/mol təşkil edir.
Elementlərin dövri sisteminin altqrupları boyunca yuxarıdan aşağıya doğru kimyəvi rabitənin enerjisi azalır, çünki bu istiqamətdə rabitə uzunluğu artır (Cədvəl 5.1). Rabitə çoxluğu artdıqca onun enerjisi də artır (Cədvəl 5.2).
Cədvəl 5.2.
Bəzi kimyəvi bağların enerjiləri
Kimyəvi bağ |
Rabitə enerjisi, |
Kimyəvi bağ |
Rabitə enerjisi, |
C - C |
|||
Kovalent rabitələrin doyma və istiqamətliliyi
Kovalent bağın ən mühüm xüsusiyyətləri onun doyma və yönləndirməsidir. Doyma qabiliyyəti atomların məhdud sayda kovalent bağlar yaratmaq qabiliyyəti kimi müəyyən edilə bilər. Beləliklə, bir karbon atomu yalnız dörd, bir oksigen atomu isə iki kovalent rabitə yarada bilər. Atomun yarada bildiyi adi kovalent bağların maksimum sayı (donor-akseptor mexanizmi ilə əmələ gələn bağlar istisna olmaqla) qoşalaşmamış elektronların sayına bərabərdir.
Kovalent bağlar məkan oriyentasiyasına malikdir, çünki tək bir əlaqənin meydana gəlməsi zamanı orbitalların üst-üstə düşməsi atomların nüvələrini birləşdirən xətt boyunca baş verir. Molekulun elektron orbitallarının fəza düzülüşü onun həndəsəsini müəyyən edir. Kimyəvi bağlar arasındakı bucaqlara bağ bucaqları deyilir.
Kovalent bağın doyma və istiqamətliliyi bu bağı kovalent bağdan fərqli olaraq doymamış və istiqamətsiz olan ion bağından fərqləndirir.
H 2 O və NH 3 molekullarının məkan quruluşu
H 2 O və NH 3 molekullarının nümunəsindən istifadə edərək kovalent bağın istiqamətini nəzərdən keçirək.
H 2 O molekulu bir oksigen atomu və iki hidrogen atomundan əmələ gəlir. Oksigen atomunda bir-birinə düz bucaq altında yerləşən iki orbitalı tutan iki qoşalaşmamış p elektronu var. Hidrogen atomlarının qoşalaşmamış 1s elektronları var. p-elektronların yaratdığı bağlar arasındakı bucaq p-elektronların orbitalları arasındakı bucağa yaxın olmalıdır. Lakin eksperimental olaraq müəyyən edilmişdir ki, su molekulunda O-H bağları arasındakı bucaq 104,50-dir. 90 o bucaqla müqayisədə bucağın artması hidrogen atomları arasında hərəkət edən itələyici qüvvələrlə izah edilə bilər, Şəkil 1. 5.11. Beləliklə, H 2 O molekulu bucaq formasına malikdir.
NH 3 molekulunun əmələ gəlməsində orbitalları üç qarşılıqlı perpendikulyar istiqamətdə yerləşən azot atomunun üç qoşalaşmamış p-elektronu iştirak edir. Buna görə də, üç N-H bağı bir-birinə 90 ° -ə yaxın bucaqlarda yerləşdirilməlidir (şək. 5.11). NH 3 molekulundakı bağlar arasındakı bucağın eksperimental qiyməti 107,3°-dir. Bağlar və nəzəri dəyərlər arasındakı bucaqlar arasındakı fərq, su molekulunda olduğu kimi, hidrogen atomlarının qarşılıqlı itələnməsi ilə əlaqədardır. Bundan əlavə, təqdim olunan sxemlər kimyəvi bağların yaranmasında 2s orbitallarında iki elektronun iştirakının mümkünlüyünü nəzərə almır.

düyü. 5.11. H 2 O (a) və NH 3 (b) molekullarında kimyəvi bağların əmələ gəlməsi zamanı elektron orbitalların üst-üstə düşməsi
BeC1 2 molekulunun əmələ gəlməsini nəzərdən keçirək. Həyəcanlı vəziyyətdə olan berillium atomunun iki qoşalaşmamış elektronu var: 2s və 2p. Ehtimal etmək olar ki, berillium atomu iki rabitə yaratmalıdır: biri s-elektron tərəfindən əmələ gələn bir rabitə və bir əlaqə p-elektron tərəfindən yaradılmışdır. Bu bağların müxtəlif enerjiləri və müxtəlif uzunluqları olmalıdır. Bu vəziyyətdə BeCl 2 molekulu xətti deyil, bucaqlı olmalıdır. Təcrübə göstərir ki, BeCl 2 molekulu xətti quruluşa malikdir və içindəki hər iki kimyəvi bağ ekvivalentdir. BCl 3 və CCl 4 molekullarının strukturunu nəzərdən keçirərkən oxşar vəziyyət müşahidə olunur - bu molekullardakı bütün bağlar ekvivalentdir. BC1 3 molekulu düz quruluşa malikdir, CC1 4 tetraedral quruluşa malikdir.
BeCl 2, BCl 3 və CCl 4 kimi molekulların quruluşunu izah etmək üçün, Pauling və Slater(ABŞ) atom orbitallarının hibridləşməsi konsepsiyasını təqdim etmişdir. Onlar enerjilərinə görə çox da fərqlənməyən bir neçə atom orbitalını hibrid adlanan eyni sayda ekvivalent orbitallarla əvəz etməyi təklif etdilər. Bu hibrid orbitallar xətti birləşməsi nəticəsində atom orbitallarından ibarətdir.
L.Paulinqin fikrincə, kimyəvi bağlar bir təbəqədə müxtəlif tipli elektronlara malik olan və buna görə də enerji baxımından çox da fərqli olmayan (məsələn, s və p) atom tərəfindən əmələ gəldikdə, onların orbitallarının konfiqurasiyasını dəyişmək mümkündür. müxtəlif növlər, onların forma və enerji baxımından uyğunlaşması baş verir. Nəticədə asimmetrik formaya malik olan və nüvənin bir tərəfində çox uzanan hibrid orbitallar əmələ gəlir. Qeyd etmək lazımdır ki, hibridləşmə modelindən müxtəlif növ elektronlar, məsələn, s və p rabitələrin formalaşmasında iştirak etdikdə istifadə olunur.
5.1.8.2. Atom orbital hibridləşməsinin müxtəlif növləri
sp hibridləşməsi
Birinin hibridləşməsi s- və bir R- orbitallar ( sp- hibridləşmə) məsələn, berilyum xloridin əmələ gəlməsi zamanı həyata keçirilir. Yuxarıda göstərildiyi kimi, həyəcanlı vəziyyətdə bir Be atomunun biri 2s orbitalını, digəri isə 2p orbitalını tutan iki qoşalaşmamış elektrona malikdir. Kimyəvi əlaqə yarandıqda bu iki müxtəlif orbital bir-birinə 180° bucaq altında yönəldilmiş iki eyni hibrid orbitala çevrilir (şək. 5.12). İki hibrid orbitalın xətti düzülüşü onların bir-birindən minimal itələnməsinə uyğundur. Nəticədə, BeCl 2 molekulu xətti bir quruluşa malikdir - hər üç atom eyni xəttdə yerləşir.

düyü. 5.12. BeCl 2 molekulunun əmələ gəlməsi zamanı elektron orbitalının üst-üstə düşməsinin diaqramı
Asetilen molekulunun quruluşu; siqma və pi bağları
Asetilen molekulunun əmələ gəlməsi zamanı elektron orbitalların üst-üstə düşməsinin diaqramını nəzərdən keçirək. Asetilen molekulunda hər bir karbon atomu sp-hibrid vəziyyətdədir. İki sp-hibrid orbital bir-birinə 1800 bucaq altında yerləşir; karbon atomları arasında bir σ rabitəsi və hidrogen atomları ilə iki σ rabitəsi əmələ gətirirlər (şək. 5.13).

düyü. 5.13. Asetilen molekulunda s-bağlarının əmələ gəlmə sxemi
σ rabitəsi atomların nüvələrini birləşdirən xətt boyunca elektron orbitalların üst-üstə düşməsi nəticəsində yaranan rabitədir.
Asetilen molekulunda hər bir karbon atomunda σ bağlarının əmələ gəlməsində iştirak etməyən daha iki p-elektron vardır. Bu elektronların elektron buludları qarşılıqlı perpendikulyar müstəvilərdə yerləşir və bir-biri ilə üst-üstə düşərək, hibrid olmayanların yanal üst-üstə düşməsi səbəbindən karbon atomları arasında daha iki π bağı əmələ gətirir. R–buludlar (şək. 5.14).
π rabitəsi atomların nüvələrini birləşdirən xəttin hər iki tərəfində elektron sıxlığının artması nəticəsində yaranan kovalent kimyəvi rabitədir.

düyü. 5.14. Asetilen molekulunda σ - və π - bağlarının əmələ gəlməsi sxemi.
Beləliklə, asetilen molekulunda karbon atomları arasında bir σ - bağ və iki π - bağdan ibarət üçlü rabitə əmələ gəlir; σ -bağlar π- bağlardan daha güclüdür.
sp2 hibridləşməsi
BCl 3 molekulunun quruluşu baxımından izah edilə bilər sp 2- hibridləşmə. Xarici elektron təbəqəsində həyəcanlanmış vəziyyətdə olan bor atomu bir s-elektron və iki p-elektronu ehtiva edir, yəni. üç qoşalaşmamış elektron. Bu üç elektron bulud üç ekvivalent hibrid orbitala çevrilə bilər. Üç hibrid orbitalın bir-birindən minimum itələnməsi onların eyni müstəvidə bir-birinə 120 o bucaq altında yerləşməsinə uyğun gəlir (şək. 5.15). Beləliklə, BCl 3 molekulu düz bir forma malikdir.

düyü. 5.15. BCl 3 molekulunun düz quruluşu
sp 3 - hibridləşmə
Karbon atomunun valentlik orbitalları (s, р x, р y, р z) kosmosda bir-birinə 109,5 o bucaq altında yerləşən və tetraedrin təpələrinə yönəldilmiş dörd ekvivalent hibrid orbitala çevrilə bilər. , mərkəzində karbon atomunun nüvəsi yerləşir (şək. 5.16).
düyü. 5.16. Metan molekulunun tetraedral quruluşu
5.1.8.3. Tək elektron cütlərinin iştirakı ilə hibridləşmə
Hibridləşmə modeli molekulların quruluşunu izah etmək üçün istifadə edilə bilər ki, onlar bağlananlardan əlavə, tək elektron cütlərini də ehtiva edir. Su və ammonyak molekullarında mərkəzi atomun (O və N) elektron cütlərinin ümumi sayı dörddür. Eyni zamanda, bir su molekulunda iki, ammonyak molekulunda isə bir tək cüt elektron var. Bu molekullarda kimyəvi bağların əmələ gəlməsini tək elektron cütlərinin hibrid orbitalları da doldura biləcəyini fərz etməklə izah etmək olar. Tək elektron cütləri kosmosda bağlananlardan daha çox yer tutur. Tək və birləşən elektron cütləri arasında baş verən itələmə nəticəsində su və ammonyak molekullarında bağlanma bucaqları azalır ki, bu da 109,5 o-dan az olur.

düyü. 5.17. sp 3 – H 2 O (A) və NH 3 (B) molekullarında tək elektron cütlərinin iştirakı ilə hibridləşmə
5.1.8.4. Hibridləşmə növünün müəyyən edilməsi və molekulların quruluşunun müəyyən edilməsi
Hibridləşmənin növünü və nəticədə molekulların quruluşunu təyin etmək üçün aşağıdakı qaydalardan istifadə edilməlidir.
1. Tərkibində tək elektron cütləri olmayan mərkəzi atomun hibridləşmə növü siqma bağlarının sayı ilə müəyyən edilir. İki belə bağ varsa, sp-hibridləşmə baş verir, üç - sp 2 - hibridləşmə, dörd - sp 3 - hibridləşmə. Tək elektron cütləri (donor-qəbuledici mexanizm tərəfindən əmələ gələn bağlar olmadıqda) berilyum, bor, karbon, silisium atomları tərəfindən əmələ gələn molekullarda yoxdur, yəni. II - IV qrupların əsas alt qruplarının elementlərində.
2. Əgər mərkəzi atomda tək elektron cütləri varsa, onda hibrid orbitalların sayı və hibridləşmə növü siqma rabitələrinin sayı və tək elektron cütlərinin sayının cəmi ilə müəyyən edilir. Tək elektron cütlərinin iştirakı ilə hibridləşmə azot, fosfor, oksigen, kükürd atomları tərəfindən əmələ gələn molekullarda baş verir, yəni. V və VI qrupların əsas alt qruplarının elementləri.
3. Molekulların həndəsi forması mərkəzi atomun hibridləşmə növü ilə müəyyən edilir (cədvəl 5.3).
Cədvəl 5.3.
Bağ bucaqları, hibrid orbitalların sayından və mərkəzi atomun hibridləşmə növündən asılı olaraq molekulların həndəsi forması
5.2. İon bağı
İon rabitəsi əks yüklü ionlar arasında elektrostatik cazibə ilə baş verir. Bu ionlar elektronların bir atomdan digərinə keçməsi nəticəsində əmələ gəlir. Elektromənfilikdə böyük fərqlərə malik olan atomlar arasında (adətən Pauling şkalası üzrə 1,7-dən çox), məsələn, qələvi metal və halogen atomları arasında ion rabitəsi yaranır.
NaCl-in əmələ gəlməsi nümunəsindən istifadə edərək ion bağının baş verməsini nəzərdən keçirək. Na 1s 2 2s 2 2p 6 3s 1 və Cl 1s 2 2s 2 2p 6 3s 2 3p 5 atomlarının elektron düsturlarından aydın olur ki, xarici səviyyəni tamamlamaq üçün natrium atomunun bir elektrondan imtina etməsi daha asandır. yeddi əlavə etməkdənsə, xlor atomu üçün bir əlavə etmək, yeddi verməkdən daha asandır. Kimyəvi reaksiyalarda natrium atomu bir elektron verir, xlor atomu isə onu alır. Nəticədə, natrium və xlor atomlarının elektron qabıqları nəcib qazların sabit elektron qabıqlarına çevrilir (natrium katyonunun elektron konfiqurasiyası Na + 1s 2 2s 2 2p 6 və xlor anionunun elektron konfiqurasiyası Cl – - 1s 2 2s 2 2p 6 3s 2 3p 6). İonların elektrostatik qarşılıqlı təsiri NaCl molekulunun əmələ gəlməsinə səbəb olur.
İon rabitələrinin əsas xarakteristikası və ion birləşmələrinin xassələri
1. İon rabitəsi güclü kimyəvi bağdır. Bu bağın enerjisi 300-700 kJ/mol səviyyəsindədir.
2. Kovalent rabitədən fərqli olaraq ion rabitəsidir istiqamətsiz, çünki bir ion əks işarəli ionları istənilən istiqamətdə özünə cəlb edə bilər.
3. Kovalent rabitədən fərqli olaraq ion rabitəsidir doymamış, çünki əks işarəli ionların qarşılıqlı təsiri onların qüvvə sahələrinin tam qarşılıqlı kompensasiyasına səbəb olmur.
4. İon rabitəsi olan molekulların əmələ gəlməsi zamanı elektronların tam köçürülməsi baş vermir, ona görə də təbiətdə yüz faiz ion rabitəsi mövcud deyil. NaCl molekulunda kimyəvi bağ yalnız 80% iondur.
5. İon rabitəsi olan birləşmələr yüksək ərimə və qaynama nöqtələrinə malik olan kristal bərk maddələrdir.
6. İon birləşmələrinin əksəriyyəti suda həll olur. İon birləşmələrinin məhlulları və ərimələri elektrik cərəyanını keçirir.
5.3. Metal əlaqə
Xarici enerji səviyyəsində olan metal atomları az sayda valent elektronları ehtiva edir. Metal atomlarının ionlaşma enerjisi az olduğu üçün bu atomlarda valent elektronlar zəif saxlanılır. Nəticədə metalların kristal qəfəslərində müsbət yüklü ionlar və sərbəst elektronlar meydana çıxır. Bu vəziyyətdə metal kationları onların kristal qəfəslərinin düyünlərində yerləşir və elektronlar "elektron qazı" adlanan müsbət mərkəzlər sahəsində sərbəst hərəkət edirlər. İki kation arasında mənfi yüklü elektronun olması hər bir katyonun bu elektronla qarşılıqlı təsirinə səbəb olur. Beləliklə, metal bağ metal kristallarındakı müsbət ionlar arasındakı əlaqədir və bu, kristal boyunca sərbəst hərəkət edən elektronların cəlb edilməsi ilə baş verir.
Metaldakı valentlik elektronları kristal boyunca bərabər paylandığından, ion rabitəsi kimi metal rabitə də istiqamətsiz bir əlaqədir. Kovalent bağdan fərqli olaraq, metal rabitə doymamış bir bağdır. Kovalent bağdan metal əlaqə Davamlılığı ilə də fərqlənir. Metal rabitənin enerjisi kovalent rabitənin enerjisindən təxminən üç-dörd dəfə azdır.
Elektron qazın yüksək hərəkətliliyinə görə metallar yüksək elektrik və istilik keçiriciliyi ilə xarakterizə olunur.
5.4. Hidrogen bağı
HF, H 2 O, NH 3 birləşmələrinin molekullarında güclü elektronmənfi elementə (H–F, H–O, H–N) malik hidrogen bağları mövcuddur. Belə birləşmələrin molekulları arasında meydana gələ bilər molekullararası hidrogen bağları. H–O, H–N bağları olan bəzi üzvi molekullarda, molekuldaxili hidrogen bağları.
Hidrogen bağının əmələ gəlməsi mexanizmi qismən elektrostatik, qismən donor-akseptor xarakterlidir. Bu halda elektron cütünün donoru güclü elektronmənfi elementin (F, O, N) atomu, qəbuledicisi isə bu atomlara bağlı hidrogen atomlarıdır. Kovalent bağlar kimi, hidrogen bağları ilə xarakterizə olunur diqqət kosmosda və doyma qabiliyyəti.
Hidrogen bağları adətən nöqtələrlə işarələnir: H ··· F. Hidrogen rabitəsi nə qədər güclü olarsa, partnyor atomun elektronmənfiliyi bir o qədər çox olar və ölçüsü bir o qədər kiçik olar. O, ilk növbədə flüor birləşmələri, eləcə də oksigen, daha az dərəcədə azot və daha az dərəcədə xlor və kükürd üçün xarakterikdir. Hidrogen rabitəsinin enerjisi də müvafiq olaraq dəyişir (Cədvəl 5.4).
Cədvəl 5.4.
Hidrogen rabitəsi enerjilərinin orta dəyərləri
Molekullararası və molekuldaxili hidrogen bağı
Hidrogen bağları sayəsində molekullar dimerlərə və daha mürəkkəb birləşmələrə birləşir. Məsələn, qarışqa turşusu dimerinin əmələ gəlməsi aşağıdakı diaqramla göstərilə bilər (şək. 5.18).

düyü. 5.18. Qarışqa turşusunda molekullararası hidrogen bağlarının əmələ gəlməsi
Suda (H 2 O) n assosiativlərinin uzun zəncirləri görünə bilər (Şəkil 5.19).

düyü. 5.19. Molekullararası hidrogen bağları hesabına maye suda assosiasiya zəncirinin əmələ gəlməsi
Hər bir H2O molekulu dörd hidrogen bağı yarada bilər, lakin HF molekulu yalnız ikisini yarada bilər.
Hidrogen bağları həm müxtəlif molekullar arasında (molekullararası hidrogen bağı), həm də molekul daxilində (molekuldaxili hidrogen bağı) yarana bilər. Bəzi üzvi maddələr üçün molekuldaxili bağların əmələ gəlməsinə dair nümunələr Şek. 5.20.

düyü. 5.20. Müxtəlif üzvi birləşmələrin molekullarında molekuldaxili hidrogen bağlarının əmələ gəlməsi
Hidrogen bağının maddələrin xassələrinə təsiri
Molekullararası hidrogen bağlarının mövcudluğunun ən əlverişli göstəricisi maddənin qaynama nöqtəsidir. Suyun daha yüksək qaynama nöqtəsi (oksigen alt qrupunun elementlərinin (H 2 S, H 2 Se, H 2 Te) hidrogen birləşmələri ilə müqayisədə 100 o C) hidrogen bağlarının olması ilə izah olunur: molekullararası birləşmələri məhv etmək üçün əlavə enerji sərf edilməlidir. suda hidrogen bağları.
Hidrogen bağı maddələrin quruluşuna və xassələrinə əhəmiyyətli dərəcədə təsir göstərə bilər. Molekullararası hidrogen bağlarının olması maddələrin ərimə və qaynama nöqtələrini artırır. Molekuldaxili hidrogen bağının olması dezoksiribonuklein turşusu (DNT) molekulunun suda ikiqat spiral şəklində bükülməsinə səbəb olur.
Hidrogen əlaqəsi həllolma proseslərində də mühüm rol oynayır, çünki həllolma eyni zamanda birləşmənin həlledici ilə hidrogen bağları yaratmaq qabiliyyətindən asılıdır. Nəticədə, şəkər, qlükoza, spirtlər və karboksilik turşular kimi OH qrupları olan maddələr, bir qayda olaraq, suda yüksək dərəcədə həll olunur.
5.5. Kristal qəfəslərin növləri
Bərk maddələr adətən kristal quruluşa malikdir. Kristalları təşkil edən hissəciklər (atomlar, ionlar və ya molekullar) kosmosda ciddi şəkildə müəyyən edilmiş nöqtələrdə yerləşərək kristal qəfəs əmələ gətirirlər. Kristal qəfəs verilmiş qəfəsə xas olan struktur xüsusiyyətlərini saxlayan elementar hüceyrələrdən ibarətdir. Hissəciklərin yerləşdiyi nöqtələr deyilir kristal qəfəs düyünləri. Şəbəkə yerlərində yerləşən hissəciklərin növündən və onlar arasındakı əlaqənin xarakterindən asılı olaraq 4 növ kristal qəfəslər fərqləndirilir.
5.5.1. Atom kristal qəfəsi
Atom kristal qəfəslərinin düyünlərində bir-biri ilə kovalent bağlarla bağlanmış atomlar var. Atom qəfəsi olan maddələrə almaz, silisium, karbidlər, silisidlər və s. Atom kristalının quruluşunda ayrı-ayrı molekulları təcrid etmək mümkün deyil, bütün kristal bir nəhəng molekul kimi qəbul edilir. Almazın quruluşu Şəkildə göstərilmişdir. 5.21. Almaz, hər biri dörd qonşu atomla bağlanmış karbon atomlarından ibarətdir. Kovalent bağların güclü olması səbəbindən atom qəfəsləri olan bütün maddələr odadavamlı, sərt və az uçucudur. Onlar suda az həll olunur.

düyü. 5.21. Almaz kristal qəfəs
5.5.2. Molekulyar kristal qəfəs
Molekulyar kristal qəfəslərin düyünlərində bir-biri ilə zəif molekullararası qüvvələrlə bağlanmış molekullar var. Buna görə molekulyar qəfəsli maddələr aşağı sərtliyə malikdir, əriyir, əhəmiyyətli uçuculuq ilə xarakterizə olunur, suda bir qədər həll olunur və onların məhlulları, bir qayda olaraq, elektrik cərəyanını keçirmir. Molekulyar kristal qəfəsi olan bir çox maddə məlumdur. Bunlar bərk hidrogen, xlor, karbon monoksit (IV) və adi temperaturda qaz halında olan digər maddələrdir. Kristal üzvi birləşmələrin əksəriyyətində molekulyar qəfəs var.
5.5.3. İon kristal qəfəs
Düyünlərində ionları olan kristal qəfəslər adlanır ion. Onlar ion bağları olan maddələr, məsələn, qələvi metal halidləri ilə əmələ gəlir. İon kristallarında ayrı-ayrı molekulları ayırd etmək mümkün deyil, bütün kristal bir makromolekul kimi qəbul edilə bilər. İonlar arasındakı bağlar güclüdür, buna görə də ion qəfəsi olan maddələr aşağı uçuculuğa və yüksək ərimə və qaynama nöqtələrinə malikdir. Natrium xloridin kristal qəfəsi Şəkildə göstərilmişdir. 5.22.

düyü. 5.22. Natrium xloridin kristal qəfəsi
Bu şəkildəki açıq toplar Na + ionları, qaranlıq toplar Cl – ionlarıdır. Şəkildə solda. Şəkil 5.22-də NaCI-nin vahid hüceyrəsi göstərilir.
5.5.4. Metal kristal qəfəs
Bərk vəziyyətdə olan metallar metal kristal qəfəslər əmələ gətirir. Belə qəfəslərin yerlərində müsbət metal ionları var və valent elektronlar onların arasında sərbəst hərəkət edir. Elektronlar elektrostatik olaraq kationları cəlb edir və bununla da metal qəfəsə sabitlik verir. Bu qəfəs quruluşu metalların yüksək istilik keçiriciliyini, elektrik keçiriciliyini və plastikliyini müəyyən edir - mexaniki deformasiya zamanı kristalın bağları qırılmır və məhv edilmir, çünki onu təşkil edən ionlar elektron qaz buludunda üzən kimi görünür. Şəkildə. Şəkil 5.23 natrium kristal şəbəkəsini göstərir.

düyü. 5.23. Natrium kristal şəbəkəsi
7.11. Kovalent bağları olan maddələrin quruluşu
Bütün növ kimyəvi bağlardan yalnız kovalentinin mövcud olduğu maddələr iki qeyri-bərabər qrupa bölünür: molekulyar (çox çox) və molekulyar olmayan (daha az).
Bərk molekulyar maddələrin kristalları molekulların molekullararası qarşılıqlı təsir qüvvələri ilə zəif birləşmiş molekullardan ibarətdir. Belə kristalların yüksək gücü və sərtliyi yoxdur (buz və ya şəkər düşünün). Onların ərimə və qaynama nöqtələri də aşağıdır (bax Cədvəl 22).
Cədvəl 22. Bəzi molekulyar maddələrin ərimə və qaynama temperaturları
Maddə |
Maddə |
||||
| H 2 | – 259 | – 253 | BR 2 | – 7 | 58 |
| N 2 | – 210 | – 196 | H2O | 0 | 100 |
| HCl | – 112 | – 85 | S 4 | 44 | 257 |
| NH 3 | – 78 | – 33 | C 10 H 8 (naftalin) | 80 | 218 |
| SO 2 | – 75 | – 10 | S 8 | 119 |
Molekulyar analoqlarından fərqli olaraq, kovalent bağları olan molekulyar olmayan maddələr çox sərt kristallar əmələ gətirir. Almaz kristalları (ən sərt maddə) bu növə aiddir.
Bir almaz kristalında (şəkil 7.5) hər bir karbon atomu sadə kovalent bağlarla (sp 3 hibridləşmə) dörd digər karbon atomu ilə əlaqələndirilir. Karbon atomları üçölçülü bir çərçivə təşkil edir. Əslində bütün almaz kristalı nəhəng və çox güclü bir molekuldur.
Radioelektronika və elektron mühəndisliyində geniş istifadə edilən silikon kristalları eyni quruluşa malikdir.
Kristalın çərçivə quruluşunu pozmadan almazdakı karbon atomlarının yarısını silisium atomları ilə əvəz etsəniz, silisium karbid SiC kristalını alacaqsınız - həm də aşındırıcı material kimi istifadə olunan çox sərt bir maddə. Adi kvars qumu (silisium dioksid) də bu tip kristal maddəyə aiddir. Kvars çox sərt maddədir; "Zümrüd" adı altında aşındırıcı material kimi də istifadə olunur. Kvars quruluşu, silisium kristalında hər iki silisium atomu arasına oksigen atomları daxil etməklə asanlıqla əldə edilir. Bu halda, hər bir silisium atomu dörd oksigen atomu ilə, hər bir oksigen atomu isə iki silikon atomu ilə əlaqələndiriləcəkdir.
Almaz, silisium, kvars və buna bənzər strukturların kristallarına atom kristalları deyilir.
Atom kristalı kimyəvi bağlarla bağlanmış bir və ya bir neçə elementin atomlarından ibarət kristaldır.
Atom kristalında kimyəvi bağ kovalent və ya metal ola bilər.
Artıq bildiyiniz kimi, hər hansı bir atom kristalı, ion kristalı kimi, nəhəng bir "supermolekul"dur. Belə bir "supermolekulun" struktur formulu yazıla bilməz - yalnız onun fraqmentini göstərə bilərsiniz, məsələn:

Molekulyar maddələrdən fərqli olaraq, atom kristallarını əmələ gətirən maddələr ən odadavamlı maddələrdəndir (bax cədvəl 23.).
Cədvəl 23. Bəzi qeyri-molekulyar maddələrin ərimə və qaynama temperaturları ilə kovalent bağlar
Bu maddələr əriyəndə zəif molekullararası bağlar deyil, güclü kimyəvi bağlar pozulduğunu xatırlasaq, belə yüksək ərimə temperaturları tamamilə başa düşüləndir. Eyni səbəbdən, atom kristallarını əmələ gətirən bir çox maddələr qızdırıldıqda ərimir, lakin parçalanır və ya dərhal buxar vəziyyətinə (sublimat) çevrilir, məsələn, qrafit 3700 o C-də sublimasiya edir.
| Silikon - Si.Çox sərt, kövrək silisium kristalları metal kimi görünür, lakin buna baxmayaraq qeyri-metaldır. Elektrik keçiriciliyinin növünə görə, bu maddə müasir dünyada onun böyük əhəmiyyətini təyin edən yarımkeçiricilər kimi təsnif edilir. Silikon ən vacib yarımkeçirici materialdır. Radiolar, televizorlar, kompüterlər, müasir telefonlar, elektron saatlar, günəş panelləri və bir çox başqa məişət və sənaye cihazlarında ən vacib struktur elementləri kimi yüksək təmizlikli silisiumun monokristallarından hazırlanmış tranzistorlar, mikrosxemlər və fotoelementlər var. Texniki silisium polad istehsalında və əlvan metallurgiyada istifadə olunur. Kimyəvi xassələri baxımından silisium kifayət qədər təsirsiz bir maddədir, yalnız yüksək temperaturda reaksiya verir. Silikon dioksid - SiO 2. Bu maddənin başqa bir adı silisiumdur. Silikon dioksid təbiətdə iki formada olur: kristal və amorf. Bir çox yarı qiymətli və bəzək daşları kristal silisium dioksidin (kvars) növləridir: qaya kristalı, jasper, kalsedon, əqiq. opal isə silisiumun amorf formasıdır. Kvars təbiətdə çox geniş yayılmışdır, çünki çayların və dənizlərin səhralarında və qum sahillərindəki təpələr hamısı kvars qumudur. Kvars rəngsiz kristal, çox sərt və odadavamlı bir maddədir. Almaz və korunddan sərtlik baxımından daha aşağıdır, lakin buna baxmayaraq, aşındırıcı material kimi geniş istifadə olunur. Kvars qumu tikintidə və tikinti materialları sənayesində geniş istifadə olunur. Kvars şüşəsi temperaturun qəfil dəyişməsi zamanı çatlamadığı üçün laboratoriya şüşələri və elmi alətlərin hazırlanmasında istifadə olunur. Kimyəvi xassələrinə görə, silikon dioksid asidik oksiddir, lakin qələvilərlə yalnız əridildikdə reaksiya verir. Yüksək temperaturda silisium dioksid və qrafit silisium karbid - karborundum istehsal etmək üçün istifadə olunur. Karborundum almazdan sonra ikinci ən sərt maddədir, ondan həm də daşlama çarxları və “zımpara” hazırlamaq üçün istifadə olunur. |
7.12. Kovalent bağın polaritesi. Elektromənfilik
Yada salaq ki, müxtəlif elementlərin təcrid olunmuş atomları həm elektron vermək, həm də qəbul etmək üçün müxtəlif meyllərə malikdirlər. Bu fərqlər kovalent bağ yarandıqdan sonra da davam edir. Yəni bəzi elementlərin atomları digər elementlərin atomlarına nisbətən kovalent bağın elektron cütünü özlərinə daha güclü cəlb etməyə meyllidirlər.
Bir molekul düşünün HCl.
Bu nümunədən istifadə edərək, molar ionlaşma enerjiləri və vasitələrdən istifadə edərək elektron rabitə buludunun elektrona yerdəyişməsini necə qiymətləndirə biləcəyimizi görək. 1312 kJ/mol və 1251 kJ/mol - fərq əhəmiyyətsizdir, təxminən 5%. 73 kJ/mol və 349 kJ/mol - burada fərq daha böyükdür: xlor atomunun elektron yaxınlıq enerjisi hidrogen atomundan demək olar ki, beş dəfə çoxdur. Buradan belə nəticəyə gəlmək olar ki, hidrogen xlorid molekulunda kovalent bağın elektron cütü əsasən xlor atomuna doğru yerdəyişmişdir. Başqa sözlə, bağlanan elektronlar hidrogen atomunun yanında olduğundan daha çox xlor atomunun yanında vaxt keçirirlər. Elektron sıxlığının bu qeyri-bərabər paylanması molekulun daxilində elektrik yüklərinin yenidən paylanmasına gətirib çıxarır.Atomlarda qismən (artıq) yüklər yaranır; hidrogen atomunda müsbət, xlor atomunda isə mənfidir.
Bu halda bağın qütbləşdiyi, özü isə qütblü kovalent rabitə adlanır.
Əgər kovalent bağın elektron cütü bağlı atomların heç birinə yerdəyişməmişsə, yəni rabitə elektronları eyni dərəcədə bağlı atomlara aiddirsə, belə bir əlaqə qeyri-qütblü kovalent rabitə adlanır.
Kovalent rabitə vəziyyətində "formal yük" anlayışı da tətbiq olunur. Yalnız tərifdə ionlardan deyil, atomlardan danışmalıyıq. Ümumiyyətlə, aşağıdakı tərif verilə bilər.
Kovalent bağların yalnız mübadilə mexanizmi ilə yarandığı molekullarda atomların formal yükləri sıfıra bərabərdir. Beləliklə, HCl molekulunda həm xlor, həm də hidrogen atomlarının formal yükləri sıfırdır. Nəticə etibarilə, bu molekulda xlor və hidrogen atomlarının həqiqi (effektiv) yükləri qismən (artıq) yüklərə bərabərdir.
Molar ionlaşma enerjiləri və elektroda yaxınlıq əsasında molekuldakı bu və ya digər elementin atomunun qismən yükünün işarəsini təyin etmək, yəni elektron cüt bağların hansı istiqamətdə olduğunu təxmin etmək həmişə asan deyil. dəyişdi. Adətən, bu məqsədlər üçün bir atomun başqa bir enerji xarakteristikasından istifadə olunur - elektronmənfilik.
Hal-hazırda elektromənfilik üçün vahid, ümumi qəbul edilmiş təyinat yoxdur. E/O hərfləri ilə qeyd oluna bilər. Elektromənfiliyin hesablanması üçün vahid, ümumi qəbul edilmiş üsul da yoxdur. Sadələşdirilmiş şəkildə, molar ionlaşma enerjilərinin və elektron yaxınlığının cəminin yarısı kimi təqdim edilə bilər - bu, onu hesablamaq üçün ilk üsullardan biri idi.
Müxtəlif elementlərin atomlarının elektronmənfiliyinin mütləq dəyərləri çox nadir hallarda istifadə olunur. Ən çox istifadə olunan c ilə işarələnən nisbi elektronmənfilikdir. Əvvəlcə bu dəyər verilmiş elementin atomunun elektronmənfiliyinin litium atomunun elektronmənfiliyinə nisbəti kimi müəyyən edilmişdir. Sonradan onun hesablanması üsulları bir qədər dəyişdi.
Nisbi elektronmənfilik ölçüsüz kəmiyyətdir. Onun dəyərləri Əlavə 10-da verilmişdir.
Nisbi elektronmənfilik ilk növbədə atomun ionlaşma enerjisindən asılı olduğundan (elektron yaxınlıq enerjisi həmişə çox aşağıdır), onda kimyəvi elementlər sistemində ionlaşma enerjisi ilə təxminən eyni şəkildə dəyişir, yəni seziumdan diaqonal olaraq artır (0,86) flüora (4.10). Cədvəldə verilmiş helium və neonun nisbi elektronmənfiliyinin dəyərlərinin praktik əhəmiyyəti yoxdur, çünki bu elementlər birləşmələr əmələ gətirmir.
Elektromənfilik cədvəlindən istifadə edərək, bu atomları birləşdirən elektronların iki atomdan hansına doğru yerdəyişdiyini və deməli, bu atomlarda yaranan qismən yüklərin əlamətlərini asanlıqla müəyyən edə bilərsiniz.
| H2O | Bağlantı qütbdür | |||
| H 2 | Atomlar eynidir | H H | Bağlantı qeyri-qütbdür | |
| CO2 | Bağlantı qütbdür | |||
| Cl2 | Atomlar eynidir | Cl--Cl | Bağlantı qeyri-qütbdür | |
| H2S | Bağlantı qütbdür |
Belə ki, müxtəlif elementlərin atomları arasında kovalent əlaqə yarandıqda belə bir əlaqə həmişə qütblü olacaq, eyni elementin atomları arasında (sadə maddələrdə) kovalent rabitə yarandıqda bağ əksər hallarda qeyri-polyar olur.
Bağlanmış atomların elektronmənfilik fərqi nə qədər çox olarsa, bu atomlar arasındakı kovalent bağ bir o qədər qütblü olur.
| Hidrogen sulfid H 2 S– çürük yumurtalara xas olan xarakterik qoxu olan rəngsiz qaz; zəhərli. İstilik baxımından qeyri-sabitdir və qızdırıldıqda parçalanır. Hidrogen sulfid suda az həll olur, onun sulu məhlulu hidrosulfid turşusu adlanır. Hidrogen sulfid metalların korroziyasını təhrik edir (kataliz edir), gümüşün qaralması üçün "günahkar" olan bu qazdır. Təbii olaraq bəzi mineral sularda olur. Həyat prosesində bəzi bakteriyalar tərəfindən əmələ gəlir. Hidrogen sulfid bütün canlılar üçün dağıdıcıdır. Qara dənizin dərinliklərində hidrogen sulfid təbəqəsi aşkar edilib və alimləri narahat edir: orada dəniz sakinlərinin həyatı daim təhlükə altındadır. |
QÜTÜBÜK KOVALENT RAQIQI, QEYRİQÜTBEYİ KOVALENT BAĞI, MÜTLÜQ ELEKTRONƏQTİVİYET, NİSİ ELEKTRONƏQTİVLİK.
1. Təcrübələr və sonrakı hesablamalar göstərdi ki, silisium tetrafloriddə silisiumun effektiv yükü +1,64 e, ksenon heksafloriddə ksenonun +2,3 e.Bu birləşmələrdə flüor atomlarının qismən yüklərinin qiymətlərini təyin edin. 2. Aşağıdakı maddələrin struktur düsturlarını tərtib edin və "" və "" işarələrindən istifadə edərək, bu birləşmələrin molekullarında kovalent bağların polaritesini xarakterizə edin: a) CH 4, CCl 4, SiCl 4; b) H 2 O, H 2 S, H 2 Se, H 2 Te; c) NH 3, NF 3, NCl 3; d) SO 2, Cl 2 O, OF 2.
3. Elektromənfilik cədvəlindən istifadə edərək birləşmələrdən hansında rabitənin daha çox qütblü olduğunu göstərin: a) CCl 4 və ya SiCl 4 ; b) H 2 S və ya H 2 O; c) NF 3 və ya NCl 3; d) Cl 2 O və ya OF 2.
7.13. Bağ əmələ gəlməsinin donor-akseptor mexanizmi
Əvvəlki paraqraflarda siz iki növ bağ haqqında ətraflı öyrəndiniz: ion və kovalent. Xatırladaq ki, bir elektron bir atomdan digərinə tamamilə köçürüldükdə ion rabitəsi yaranır. Kovalent - bağlanmış atomların qoşalaşmamış elektronlarını paylaşdıqda.
Bundan əlavə, bağın formalaşması üçün başqa bir mexanizm var. Bir ammiak molekulunun bor trifluorid molekulu ilə qarşılıqlı təsir nümunəsindən istifadə edərək bunu nəzərdən keçirək:


Nəticədə, azot və bor atomları arasında həm kovalent, həm də ion bağları yaranır. Bu vəziyyətdə azot atomu olur donor elektron cütü (bir bağın meydana gəlməsi üçün "verir") və bor atomu - qəbul edən(“əlaqə yaratarkən onu qəbul edir”). Beləliklə, belə bir əlaqənin formalaşması mexanizminin adı - " donor-qəbuledici".
Donor-akseptor mexanizmindən istifadə edərək bağ yarandıqda eyni vaxtda həm kovalent rabitə, həm də ion rabitəsi yaranır.
Təbii ki, rabitə yarandıqdan sonra bağlanmış atomların elektronmənfiliklərinin fərqliliyinə görə rabitənin qütbləşməsi baş verir və atomların təsirli (real) yüklərini azaldan qismən yüklər yaranır.

Digər nümunələrə baxaq.
Ammonyak molekulunun yanında hidrogen atomunda əhəmiyyətli qismən yük olan yüksək qütblü hidrogen xlorid molekulu varsa, bu halda elektron cütünün qəbuledici rolunu hidrogen atomu oynayacaqdır. Onun 1 s-AO, tamamilə boş olmasa da, əvvəlki nümunədəki bor atomu kimi, bu orbitalın buludunda elektron sıxlığı əhəmiyyətli dərəcədə azalır.

Yaranan katyonun fəza quruluşu ammonium ionu NH 4 metan molekulunun quruluşuna bənzəyir, yəni dörd N-H bağının hamısı tam eynidir.
Ammonium xlorid NH 4 Cl-nin ion kristallarının əmələ gəlməsini ammonyak qazını hidrogen xlorid qazı ilə qarışdırmaqla müşahidə etmək olar:
NH 3 (g) + HCl (g) = NH 4 Cl (cr)
Elektron cütünün donoru təkcə azot atomu ola bilməz. Bu, məsələn, su molekulunun oksigen atomu ola bilər. Su molekulu eyni hidrogen xlorid ilə aşağıdakı kimi qarşılıqlı təsir göstərəcək:
Nəticədə meydana gələn H3O katyonu adlanır oksonium ionu və tezliklə öyrənəcəyiniz kimi, kimyada böyük əhəmiyyət kəsb edir.
Yekun olaraq, karbonmonoksit (karbonmonoksit) CO molekulunun elektron quruluşunu nəzərdən keçirək:

Üç kovalent bağa (üçlü bağ) əlavə olaraq, bir ion bağı da ehtiva edir.
Donor-akseptor mexanizminə görə bağların əmələ gəlməsi şərtləri:
1) atomlardan birində tək cüt valent elektronun olması;
2) başqa bir atomun valentlik alt səviyyəsində sərbəst orbitalın olması.
Bağ əmələ gəlməsinin donor-akseptor mexanizmi kifayət qədər geniş yayılmışdır. Xüsusilə tez-tez birləşmələrin əmələ gəlməsi zamanı baş verir d-elementlər. Demək olar ki, hər kəsin atomları d-elementlərin çoxlu boş valent orbitalları var. Buna görə də onlar elektron cütlərinin aktiv qəbulediciləridir.
DONOR-QƏBUL MEXANİZMİ İLƏ BAĞLARIN FAYDALANMASI DONOR-QƏBUL MEXANİZMİ, AMMONİUM İON, OKSONİUM İON, DONOR-QƏBUL MEXANİZMİ İLƏ BAĞLARIN FAYDALANMASI ŞƏRTLƏRİ.
1.Reaksiya tənliklərini və əmələ gəlmə sxemlərini qurun
a) ammonium bromid NH 4 Br ammonyak və hidrogen bromiddən;
b) ammonyak və sulfat turşusundan ammonium sulfat (NH 4) 2 SO 4.
2. a) hidrogen bromid ilə suyun reaksiya tənliklərini və qarşılıqlı təsir sxemlərini qurun; b) sulfat turşusu ilə su.
3. Əvvəlki dörd reaksiyada hansı atomlar elektron cütünün donorları, hansılar isə akseptorlardır? Niyə? Cavabınızı valent alt səviyyələrin diaqramları ilə izah edin.
4.Azot turşusunun struktur düsturu O–N–O bağları arasındakı bucaqlar 120 o-ya yaxındır. Müəyyənləşdirmək:
a) azot atomunun hibridləşmə növü;
b) azot atomunun hansı AO-su -bağının yaranmasında iştirak edir;
c) azot atomunun hansı AO-su donor-akseptor mexanizminə görə -bağının yaranmasında iştirak edir.
Sizcə, bu molekuldakı H–O–N bağları arasındakı bucaq təxminən neçəyə bərabərdir? 5.Sianid ionunun CN (karbon atomunun mənfi yükü) struktur formulunu yaradın. Məlumdur ki, sianidlər (tərkibində belə ion olan birləşmələr) və karbonmonoksit CO güclü zəhərlərdir və onların bioloji təsiri çox oxşardır. Onların bioloji fəaliyyətlərinin yaxınlığına dair izahat verin.
7.14. Metal birləşmə. Metallar
Yalnız bağlanmış atomların ölçüləri kiçik olduqda, elektron vermək və əldə etmək meylləri oxşar olan atomlar arasında kovalent bağ yaranır. Bu vəziyyətdə, üst-üstə düşən elektron buludları bölgəsindəki elektron sıxlığı əhəmiyyətlidir və atomlar, məsələn, HF molekulunda olduğu kimi sıx bağlıdır. Bağlanmış atomlardan ən azı biri böyük bir radiusa malikdirsə, kovalent bağın meydana gəlməsi daha az sərfəli olur, çünki böyük atomlar üçün üst-üstə düşən elektron buludları bölgəsindəki elektron sıxlığı kiçik olanlara nisbətən daha azdır. Daha zəif əlaqəyə malik belə molekula misal olaraq HI molekulunu göstərmək olar (Cədvəl 21-dən istifadə edərək, HF və HI molekullarının atomlaşma enerjilərini müqayisə edin).
Və hələ böyük atomlar arasında ( r o > 1.1) kimyəvi bağ yaranır, lakin bu halda bütün bağlı atomların valent elektronlarının hamısının (və ya bir hissəsinin) ortaq olması hesabına yaranır. Məsələn, natrium atomları vəziyyətində, hamısı 3 s-bu atomların elektronları və tək elektron buludu əmələ gəlir:

Atomlar ilə kristal əmələ gəlir Metal rabitə
Beləliklə, həm eyni elementin atomları, həm də müxtəlif elementlərin atomları bir-biri ilə bağlana bilər. Birinci halda, sadə maddələr deyilir metallar, ikincidə isə mürəkkəb maddələr adlanır intermetal birləşmələr.
Atomlar arasında metal bağları olan bütün maddələrdən siz yalnız məktəbdə metallar haqqında öyrənəcəksiniz. Metalların məkan quruluşu necədir? Metal kristal ibarətdir atom skeletləri, valent elektronların ictimailəşməsindən və sosiallaşmış elektronların elektron buludundan sonra qalan. Atom nüvələri adətən çox yaxın qablaşdırma təşkil edir və elektron buludu kristalın bütün qalan sərbəst həcmini tutur.
Sıx qablaşdırmanın əsas növləri bunlardır kub ən yaxın qablaşdırma(KPU) və altıbucaqlı yaxın qablaşdırma(GPU). Bu bağlamaların adları onların həyata keçirildiyi kristalların simmetriyası ilə bağlıdır. Bəzi metallar boş yerə yığılmış kristallar əmələ gətirir - bədən mərkəzli kub(OTSK). Bu bağlamaların həcmli və top-çubuqlu modelləri Şəkil 7.6-da göstərilmişdir.
Kub yaxın qablaşdırma Cu, Al, Pb, Au və bəzi digər elementlərin atomlarından əmələ gəlir. Altıbucaqlı yaxın qablaşdırma - Be, Zn, Cd, Sc və bir sıra başqalarının atomları. Atomların bədən mərkəzli kubik qablaşdırılması qələvi metalların kristallarında, VB və VIB qruplarının elementlərində mövcuddur. Bəzi metallar müxtəlif temperaturlarda fərqli strukturlara malik ola bilər. Metalların bu cür fərqliliklərinin və struktur xüsusiyyətlərinin səbəbləri hələ də tam başa düşülməyib.
Ərindikdə metal kristallar çevrilir metal mayelər. Atomlar arasındakı kimyəvi bağın növü dəyişmir.
Metal bağın istiqamətliliyi və doyması yoxdur. Bu baxımdan ion bağına bənzəyir.
İntermetal birləşmələr vəziyyətində metal rabitənin qütbləşmə qabiliyyətindən də danışmaq olar.
Metalların xarakterik fiziki xüsusiyyətləri:
1) yüksək elektrik keçiriciliyi;
2) yüksək istilik keçiriciliyi;
3) yüksək çeviklik.

Müxtəlif metalların ərimə nöqtələri bir-birindən çox fərqlidir: ən aşağı ərimə nöqtəsi civə (- 39 o C), ən yüksək ərimə nöqtəsi isə volfram üçün (3410 o C).
| Berillium Be- açıq boz, yüngül, kifayət qədər sərt, lakin adətən kövrək metal. Ərimə nöqtəsi 1287 o C. Havada oksid filmi ilə örtülür. Berillium kifayət qədər nadir bir metaldır, təkamül prosesində canlı orqanizmlər onunla praktiki olaraq heç bir əlaqəsi yox idi, buna görə də onun heyvanlar aləminə zəhərli olması təəccüblü deyil. Nüvə texnologiyasında istifadə olunur. Sink Zn mavi rəngli yumşaq ağ metaldır. Ərimə nöqtəsi 420 o C. Havada və suda daha çox oksidləşmənin qarşısını alan sink oksidin nazik bir sıx filmi ilə örtülmüşdür. İstehsalda təbəqələri, boruları, məftilləri sinkləmək, dəmiri korroziyadan qorumaq üçün istifadə olunur. Volfram W. O, bütün metallar arasında ən odadavamlıdır: volframın ərimə nöqtəsi 3387 o C-dir. Tipik olaraq, volfram olduqca kövrəkdir, lakin diqqətlə təmizləndikdən sonra çevik olur, bu da ondan nazik məftil çəkməyə imkan verir, ondan filamentlər işıq lampaları hazırlanır. Bununla belə, istehsal olunan volframın çox hissəsi hətta 1000 o C-yə qədər qızdırıldıqda bu xüsusiyyətləri saxlaya bilən sərt və aşınmaya davamlı ərintilərin istehsalı üçün istifadə olunur. |
METAL, İNTERMETALLİK MÜRÜKƏLƏ, METALLİK BİRLİK, SıX QABLAMA.
1. Müxtəlif paketləri xarakterizə etmək üçün “boşluq doldurma əmsalı” anlayışından, yəni atomların həcminin kristalın həcminə nisbətindən istifadə olunur.
Harada V a - atomun həcmi,
Z vahid hüceyrədəki atomların sayıdır,
V i- vahid hüceyrənin həcmi.
Bu vəziyyətdə atomlar radiuslu sərt toplarla təmsil olunur R, bir-birinə toxunur. Topun həcmi V w = (4/3) R 3 .
Toplu və bcc qablaşdırma üçün yer doldurma əmsalını təyin edin.
2. Metal radiusların dəyərlərindən istifadə edərək (Əlavə 9) a) mis (CPU), b) alüminium (CPU) və c) seziumun (BCC) vahid hüceyrə ölçüsünü hesablayın.
E.N.Frenkel
Kimya dərsliyi
Kimyanı bilməyən, amma öyrənmək və anlamaq istəyənlər üçün dərslik
I hissə. Ümumi kimya elementləri
(birinci çətinlik səviyyəsi)
Davamı. Görmək № 13, 18, 23/2007;
6/2008
Fəsil 4. Kimyəvi birləşmə anlayışı
Bu təlimatın əvvəlki fəsillərində maddənin molekullardan, molekulların isə atomlardan ibarət olması faktı müzakirə olunurdu. Heç düşünmüsünüzmü: molekulu təşkil edən atomlar niyə müxtəlif istiqamətlərdə uçmurlar? Bir molekulda atomları tutan nədir?
Onları geri saxlayır kimyəvi bağ .
Kimyəvi əlaqənin mahiyyətini başa düşmək üçün sadə fiziki təcrübəni xatırlamaq kifayətdir. Simlər üzərində yan-yana asılmış iki top heç bir şəkildə bir-birinə “reaksiya” vermir. Amma bir topa müsbət, digərinə isə mənfi yük versəniz, onlar bir-birini cəlb edəcəklər. Atomları bir-birinə çəkən qüvvə bu deyilmi? Həqiqətən, araşdırmalar bunu göstərdi kimyəvi bağ elektrik xarakterlidir.
Neytral atomlardakı yüklər haradan gəlir?
Məqalə "İmtahan" Vahid Dövlət İmtahanına hazırlaşmaq üçün onlayn kursun dəstəyi ilə dərc edilmişdir. Saytda Vahid Dövlət İmtahanına müstəqil hazırlıq üçün bütün lazımi materialları tapa bilərsiniz - hər bir istifadəçi üçün unikal hazırlıq planı tərtib etmək, hər bir mövzu, nəzəriyyə və tapşırıqlar üzrə irəliləyişləri izləmək. Bütün tapşırıqlar ən son dəyişikliklərə və əlavələrə uyğundur. Qiymətləndirmə meyarlarına uyğun olaraq bal toplamaq və işi təhlil etmək üçün Vahid Dövlət İmtahanının yazılı hissəsindən tapşırıqları ekspertlərə göndərmək də mümkündür. Təcrübə toplamaq, səviyyələri tamamlamaq, bonuslar və mükafatlar almaq, Vahid Dövlət İmtahan Arenasında dostlarla yarışma ilə tapşırıqlar şəklində tapşırıqlar. Hazırlamağa başlamaq üçün linki izləyin: https://examer.ru.
Atomların quruluşunu təsvir edərkən, nəcib qaz atomları istisna olmaqla, bütün atomların elektron qazanmağa və ya imtina etməyə meylli olduğu göstərildi. Səbəb sabit səkkiz elektronlu xarici səviyyənin (nəcib qazlar kimi) formalaşmasıdır. Elektronları qəbul edərkən və ya verərkən elektrik yükləri yaranır və nəticədə hissəciklər arasında elektrostatik qarşılıqlı təsir yaranır. Bu belə yaranır ion bağı , yəni. ionlar arasında əlaqə.
İonlar elektronların qəbulu və ya itirilməsi nəticəsində əmələ gələn sabit yüklü hissəciklərdir.
Məsələn, aktiv metalın atomu və aktiv qeyri-metal reaksiyada iştirak edir:
Bu prosesdə bir metal atomu (natrium) elektronları verir:
![]()
a) Belə bir hissəcik sabitdirmi?
b) Natrium atomunda neçə elektron qalır?
c) Bu hissəciyin yükü olacaqmı?
Beləliklə, bu prosesdə sabit bir hissəcik əmələ gəldi (xarici səviyyədə 8 elektron), onun yükü var, çünki natrium atomunun nüvəsi hələ də +11 yükə, qalan elektronların isə ümumi yükü -10-a malikdir. Buna görə də natrium ionunun yükü +1-dir. Bu prosesin qısa qeydi belə görünür:
![]()
Kükürd atomu ilə nə baş verir? Bu atom xarici səviyyə tamamlanana qədər elektronları qəbul edir:
![]()
Sadə bir hesablama göstərir ki, bu hissəcik bir yükə malikdir:
![]()
Əks yüklü ionlar bir-birini çəkir, nəticədə ion bağı və “ion molekulu” yaranır:
6-cı fəsildə müzakirə olunacaq ionların əmələ gəlməsinin başqa yolları da var.
Formal olaraq, natrium sulfid məhz bu molekulyar tərkibə aiddir, baxmayaraq ki, ionlardan ibarət olan maddə təxminən aşağıdakı quruluşa malikdir (Şəkil 1):
Beləliklə, ionlardan ibarət maddələrin ayrı-ayrı molekulları yoxdur! Bu vəziyyətdə yalnız şərti "ion molekulu" haqqında danışa bilərik.
Tapşırıq 4.1. Atomlar arasında ion rabitəsi yarandıqda elektronların ötürülməsinin necə baş verdiyini göstərin:
a) kalsium və xlor;
b) alüminium və oksigen.
UNUTMAYIN! Metal atomu xarici elektronları verir; Qeyri-metal atom itkin elektronları qəbul edir.
Nəticə. Yuxarıda təsvir edilən mexanizmə görə, aktiv metalların atomları ilə aktiv qeyri-metallar arasında ion rabitəsi yaranır.
Tədqiqatlar göstərir ki, elektronların bir atomdan digərinə tam ötürülməsi həmişə baş vermir. Çox vaxt kimyəvi rabitə elektronların verilməsi və qəbulu ilə deyil, ümumi elektron cütlərinin əmələ gəlməsi nəticəsində yaranır*. Bu əlaqə adlanır kovalent .
Ortaq elektron cütlərinin meydana gəlməsi səbəbindən kovalent bağ yaranır. Bu növ bağ, məsələn, qeyri-metal atomları arasında yaranır. Beləliklə, azot molekulunun iki atomdan - N 2-dən ibarət olduğu məlumdur. Bu atomlar arasında kovalent bağ necə yaranır? Bu suala cavab vermək üçün azot atomunun quruluşunu nəzərdən keçirmək lazımdır:
Sual. Xarici səviyyə tamamlanana qədər neçə elektron çatışmır?
CAVAB: Üç elektron çatışmır. Buna görə də, xarici səviyyənin hər bir elektronunu nöqtə ilə işarə edərək, əldə edirik:
Sual. Niyə üç elektron tək nöqtələrlə təmsil olunur?
CAVAB: Məsələ ondadır ki, biz ortaq elektron cütlərinin əmələ gəlməsini göstərmək istəyirik. Bir cüt iki elektrondur. Belə bir cüt, xüsusən də hər bir atom bir cüt yaratmaq üçün bir elektron təmin edərsə baş verir. Azot atomunun xarici səviyyəni tamamlamaq üçün üç elektronu azdır. Bu o deməkdir ki, o, gələcək cütləri yaratmaq üçün üç tək elektronu “hazırlamalıdır” (şək. 2).
Qəbul edildi molekulun elektron formulu azot, bu, hər bir azot atomunun indi səkkiz elektrona malik olduğunu göstərir (onlardan altısı oval şəklində dövrələnmiş və 2 öz elektronu); atomlar arasında (dairələrin kəsişməsi) üç ümumi elektron cütü meydana çıxdı.
Hər bir elektron cütü bir kovalent bağa uyğundur. Neçə kovalent rabitə əmələ gəldi? üç. Hər bir əlaqəni (hər bir paylaşılan elektron cütünü) tire (valentlik vuruşu) istifadə edərək göstəririk:
![]()
Bununla belə, bütün bu düsturlar suala cavab vermir: kovalent rabitə yarandıqda atomları birləşdirən nədir? Elektron düstur atomlar arasında ortaq elektron cütünün yerləşdiyini göstərir. Kosmosun bu bölgəsində həddindən artıq mənfi yük görünür. Və atomların nüvələri, məlum olduğu kimi, müsbət yükə malikdir. Beləliklə, hər iki atomun nüvələri ümumi elektron cütləri (daha dəqiq desək, elektron buludlarının kəsişməsi) hesabına yaranan ümumi mənfi yükə cəlb olunur (şək. 3).
Müxtəlif atomlar arasında belə bir əlaqə yarana bilərmi? Ola bilər. Bir azot atomu hidrogen atomları ilə qarşılıqlı əlaqədə olsun:
Hidrogen atomunun quruluşu atomun bir elektrona malik olduğunu göstərir. Bu atomlardan neçəsini götürmək lazımdır ki, azot atomu "istədiyini əldə etsin" - üç elektron? Aydındır ki, üç hidrogen atomu
(Şəkil 4):
Şəkildə xaç. 4 hidrogen atomunun elektronlarını göstərir. Ammonyak molekulunun elektron düsturu göstərir ki, azot atomunun indi səkkiz elektronu var və hər hidrogen atomunun indi iki elektronu var (və birinci enerji səviyyəsində bundan artıq ola bilməz).
Qrafik düstur göstərir ki, azot atomunun valentliyi üç (üç tire və ya üç valent vuruş) və hər hidrogen atomunun bir valentliyi var (bir tire).
Hər iki N 2 və NH 3 molekullarında eyni azot atomu olsa da, atomlar arasındakı kimyəvi bağlar bir-birindən fərqlidir. Azot molekulunda N2 kimyəvi bağlar əmələ gəlir eyni atomlar, beləliklə ortaq elektron cütləri atomlar arasında ortada yerləşir. Atomlar neytral qalır. Bu kimyəvi bağ adlanır qeyri-qütblü .
Ammonyak NH 3 molekulunda kimyəvi bağ əmələ gəlir müxtəlif atomlar. Buna görə də atomlardan biri (bu halda azot atomu) ümumi elektron cütünü daha güclü şəkildə çəkir. Ümumi elektron cütləri azot atomuna doğru sürüşür və onun üzərində kiçik bir mənfi yük görünür və hidrogen atomunda müsbət elektrik qütbləri yaranır - bir bağ. qütb (şək. 5).
Kovalent bağlardan istifadə edərək qurulan maddələrin əksəriyyəti fərdi molekullardan ibarətdir (şək. 6).
Şəkildən. Şəkil 6 göstərir ki, atomlar arasında kimyəvi bağlar var, lakin molekullar arasında onlar yoxdur və ya əhəmiyyətsizdir.
Kimyəvi bağın növü maddənin xüsusiyyətlərinə və məhlullardakı davranışına təsir göstərir. Beləliklə, hissəciklər arasında cazibə nə qədər çox olarsa, onları bir-birindən qoparmaq bir o qədər çətindir və bərki qaz və ya maye halına çevirmək bir o qədər çətindir. Aşağıdakı diaqramda hansı hissəciklərin daha çox qarşılıqlı təsir qüvvəsinə malik olduğunu və hansı kimyəvi bağın əmələ gəldiyini müəyyən etməyə çalışın (şək. 7).
Fəsli diqqətlə oxusanız, cavabınız belə olacaq: hissəciklər arasında maksimum qarşılıqlı təsir I halda baş verir (ion bağı). Buna görə də bütün bu cür maddələr bərkdir. Yüksüz hissəciklər arasında ən az qarşılıqlı təsir (III hal - qeyri-polyar kovalent bağ). Bu cür maddələr ən çox qazlardır.
Tapşırıq 4.2. Maddələrdəki atomlar arasında hansı kimyəvi əlaqənin yarandığını müəyyən edin: NaCl, HCl, Cl 2, AlCl 3, H 2 O. İzahlar verin.
Tapşırıq 4.3. Kovalent rabitənin mövcudluğunu təyin etdiyiniz 4.2-ci tapşırıqdan həmin maddələr üçün elektron və qrafik düsturlar hazırlayın. İon rabitəsi üçün elektron ötürmə diaqramlarını çəkin.
Fəsil 5. Həll yolları
Yer üzündə həll yollarını görməmiş insan yoxdur. Və bu nədir?
Məhlul iki və ya daha çox komponentin (komponentlərin və ya maddələrin) homojen qarışığıdır.
Homojen qarışıq nədir? Qarışığın homojenliyi onun tərkib hissələri arasında olmasını nəzərdə tutur çatışmayan interfeys. Bu halda, verilmiş qarışığın neçə maddə əmələ gəldiyini ən azı vizual olaraq müəyyən etmək mümkün deyil. Məsələn, bir stəkandakı kran suyuna baxanda təsəvvür etmək çətindir ki, onun tərkibində su molekullarından əlavə yaxşı onlarla ion və molekul var (O 2, CO 2, Ca 2+ və s.). Və heç bir mikroskop bu hissəcikləri görməyə kömək etməyəcək.
Lakin interfeysin olmaması homojenliyin yeganə əlaməti deyil. Homojen bir qarışıqda qarışığın tərkibi istənilən nöqtədə eynidir. Buna görə də, bir həll əldə etmək üçün onu meydana gətirən komponentləri (maddələri) hərtərəfli qarışdırmaq lazımdır.
Həlllərin müxtəlif birləşmə vəziyyətləri ola bilər:
Qaz məhlulları (məsələn, hava - O 2, N 2, CO 2, Ar qazlarının qarışığı);
Maye məhlullar (məsələn, odekolon, şərbət, duzlu su);
Bərk məhlullar (məsələn, ərintilər).
Məhlul əmələ gətirən maddələrdən birinə deyilir həlledici. Həlledici məhlul ilə eyni birləşmə vəziyyətinə malikdir. Beləliklə, maye məhlullar üçün bu mayedir: su, yağ, benzin və s. Ən çox praktikada sulu məhlullar istifadə olunur. Onlar daha sonra müzakirə olunacaq (müvafiq qeyd edilmədiyi halda).
Müxtəlif maddələr suda həll olduqda nə baş verir? Niyə bəzi maddələr suda yaxşı, digərləri isə zəif həll olunur? Həll qabiliyyətini nə müəyyənləşdirir - maddənin suda həll olunma qabiliyyəti?
Təsəvvür edək ki, bir stəkan ilıq suya bir parça şəkər qoyulur. Orada uzandı, ölçüsü kiçildi və... yox oldu. Harada? Maddənin (onun kütləsinin, enerjisinin) qorunma qanunu pozulurmu? Yox. Yaranan məhluldan bir qurtum götürün və suyun şirin olduğuna və şəkərin itmədiyinə əmin olacaqsınız. Bəs niyə görünmür?
Fakt budur ki, həll olunarkən maddənin əzilməsi (üyüdülməsi) baş verir. Bu halda şəkər parçası molekullara parçalanıb, lakin biz onları görə bilmirik. Bəli, amma süfrədə yatan şəkər niyə molekullara parçalanmır? Niyə suya batırılmış bir parça marqarin də yox olmur? Ancaq həll olunan maddənin parçalanması bir həlledicinin, məsələn, suyun təsiri altında baş verdiyi üçün. Lakin həlledici bu hissəciklərə “tutmağı” bacararsa, kristalı, bərk maddəni molekullara “çəkə” biləcək. Başqa sözlə, bir maddə həll olunanda olmalıdır maddə və həlledici arasında qarşılıqlı əlaqə.
Belə qarşılıqlı əlaqə nə vaxt mümkündür? Yalnız maddələrin quruluşu (həm həll olunan, həm də həlledici) oxşar olduqda. Kimyagərlərin qaydası çoxdan məlumdur: "kimi kimi əriyir". Nümunələrimizdə şəkər molekulları qütbdür və onlar ilə qütb su molekulları arasında müəyyən qarşılıqlı təsir qüvvələri var. Qütb olmayan yağ molekulları ilə qütb su molekulları arasında belə qüvvələr yoxdur. Buna görə yağlar suda həll olunmur. Beləliklə, həllolma məhlulun və həlledicinin təbiətindən asılıdır.
Məhlul və su arasındakı qarşılıqlı təsir nəticəsində birləşmələr əmələ gəlir - nəmləndirir. Bunlar çox güclü əlaqələr ola bilər:

Belə birləşmələr fərdi maddələr kimi mövcuddur: əsaslar, oksigen tərkibli turşular. Təbii ki, bu birləşmələrin əmələ gəlməsi zamanı güclü kimyəvi bağlar yaranır və istilik ayrılır. Belə ki, CaO (sürətli əhəng) suda həll edildikdə o qədər istilik ayrılır ki, qarışıq qaynayır.
Bəs niyə şəkər və ya duz suda həll edildikdə, yaranan məhlul qızmır? Birincisi, bütün hidratlar sulfat turşusu və ya kalsium hidroksid qədər güclü deyil. Duzların hidratları var (kristal hidratlar) qızdırıldıqda asanlıqla parçalanan:

İkincisi, həll zamanı, artıq qeyd edildiyi kimi, sarsıdıcı bir proses baş verir. Və bu, enerji sərf edir və istiliyi udur.
Hər iki proses eyni vaxtda baş verdiyindən məhlul hansı prosesin üstünlük təşkil etməsindən asılı olaraq qızdıra və ya soyuya bilər.
Tapşırıq 5.1. Hər bir vəziyyətdə hansı prosesin - əzmə və ya nəmləndirmənin üstünlük təşkil etdiyini müəyyənləşdirin:
a) sulfat turşusunu suda həll edərkən, məhlul qızdırılırsa;
b) ammonium nitrat suda həll edildikdə, məhlul soyuduqda;
c) xörək duzu suda həll edildikdə, məhlulun temperaturu faktiki olaraq dəyişməz qalırsa.
Çözünmə zamanı məhlulun temperaturu dəyişdiyinə görə bunu ehtimal etmək təbiidir həll olması temperaturdan asılıdır. Həqiqətən də, bərk maddələrin çoxunun həllolma qabiliyyəti qızdırma ilə artır. Qızdırıldıqda qazların həllolma qabiliyyəti azalır. Buna görə də, bərk maddələr adətən isti və ya isti suda həll edilir, qazlı içkilər isə soyuq saxlanılır.
Həlledicilik(həll etmək qabiliyyəti) maddələr maddənin üyüdülməsindən və ya qarışdırma intensivliyindən asılı deyil. Ancaq temperaturu artırmaq, maddəni üyütmək, hazır məhlulu qarışdırmaqla həll prosesini sürətləndirə bilərsiniz. Məhlulun alınması şərtlərini dəyişdirərək müxtəlif tərkibli məhlulları əldə etmək mümkündür. Təbii ki, bir hədd var, ona çatdıqda maddənin artıq suda həll olunmadığını aşkar etmək asandır. Bu həll adlanır zəngin. Çox həll olunan maddələr üçün doymuş bir məhlulda çoxlu həll olan maddə olacaqdır. Beləliklə, 100 ° C-də doymuş KNO 3 məhlulu 100 q suya (345 q məhlulda) 245 q duz ehtiva edir, bu cəmlənmişdir həll. Zəif həll olunan maddələrin doymuş məhlullarında həll olunan birləşmələrin əhəmiyyətsiz kütlələri var. Beləliklə, gümüş xloridin doymuş məhlulu 100 q suda 0,15 mq AgCl ehtiva edir. Bu çox seyreltilmiş həll.
Belə ki, əgər məhlulda həllediciyə nisbətən çox məhlul varsa, konsentratlı, az maddə varsa, seyreltilmiş adlanır. Çox vaxt onun xüsusiyyətləri və buna görə də tətbiqi məhlulun tərkibindən asılıdır.
Beləliklə, sirkə turşusunun seyreltilmiş məhlulu (süfrə sirkəsi) dadlandırıcı kimi istifadə olunur və bu turşunun konsentratlı məhlulu (şifahi qəbul edildikdə sirkə mahiyyəti) ölümcül yanıqlara səbəb ola bilər.
Məhlulların kəmiyyət tərkibini əks etdirmək üçün adlanan dəyərdən istifadə edin məhlulun kütlə payı :
Harada m(v-va) – məhlulda həll olunan maddənin kütləsi; m(məhlul) – tərkibində məhlul və həlledici olan məhlulun ümumi kütləsi.
Beləliklə, 100 q sirkə 6 q sirkə turşusunu ehtiva edirsə, o zaman sirkə turşusunun 6% həllindən danışırıq (bu süfrə sirkəsidir). Məhlulun kütlə payı anlayışından istifadə etməklə məsələlərin həlli üsulları 8-ci Fəsildə müzakirə olunacaq.
5-ci fəsil üçün nəticələr. Məhlullar ən azı iki maddədən ibarət homojen qarışıqlardır, onlardan biri həlledici, digəri həlledici adlanır. Həll edildikdə, bu maddə həlledici ilə qarşılıqlı təsir göstərir, buna görə həll olunan maddə əzilir. Məhlulun tərkibi məhluldakı məhlulun kütlə payı ilə ifadə edilir.
* Bu elektron cütləri elektron buludlarının kəsişməsində meydana gəlir.
Ardı var
169338 0
Hər bir atom müəyyən sayda elektrona malikdir.
Kimyəvi reaksiyalara girərkən atomlar ən sabit elektron konfiqurasiyaya nail olaraq elektronları bağışlayır, qazanır və ya paylaşırlar. Ən aşağı enerjiyə malik konfiqurasiya (nəcib qaz atomlarında olduğu kimi) ən sabitdir. Bu nümunə “oktet qaydası” adlanır (şək. 1).
düyü. 1.
Bu qayda hər kəsə aiddir əlaqə növləri. Atomlar arasındakı elektron əlaqələr onlara ən sadə kristallardan tutmuş mürəkkəb biomolekullara qədər sabit strukturlar yaratmağa imkan verir ki, nəticədə canlı sistemlər əmələ gəlir. Onlar davamlı maddələr mübadiləsində kristallardan fərqlənirlər. Eyni zamanda bir çox kimyəvi reaksiyalar mexanizmlərə uyğun olaraq gedir elektron köçürmə, bədəndəki enerji proseslərində mühüm rol oynayan.
Kimyəvi bağ iki və ya daha çox atomu, ionu, molekulu və ya bunların hər hansı bir birləşməsini birləşdirən qüvvədir..
Kimyəvi bağın təbiəti universaldır: bu, atomların xarici qabığının elektronlarının konfiqurasiyası ilə müəyyən edilən mənfi yüklü elektronlar və müsbət yüklü nüvələr arasında elektrostatik cazibə qüvvəsidir. Atomun kimyəvi bağlar yaratmaq qabiliyyəti deyilir valentlik, və ya oksidləşmə vəziyyəti. anlayışı valent elektronlar- kimyəvi bağlar əmələ gətirən, yəni ən yüksək enerjili orbitallarda yerləşən elektronlar. Buna uyğun olaraq, bu orbitalları ehtiva edən atomun xarici qabığı deyilir valentlik qabığı. Hal-hazırda kimyəvi bir əlaqənin mövcudluğunu göstərmək kifayət deyil, lakin onun növünü aydınlaşdırmaq lazımdır: ion, kovalent, dipol-dipol, metal.
Birinci əlaqə növüion əlaqə
Lewis və Kosselin elektron valentlik nəzəriyyəsinə görə, atomlar iki yolla sabit elektron konfiqurasiya əldə edə bilər: birincisi, elektronları itirərək, kationlar, ikincisi, onları əldə etmək, çevrilmək anionlar. Elektron ötürülməsi nəticəsində əks işarəli yüklü ionlar arasında elektrostatik cazibə qüvvəsi hesabına Kossel adlanan kimyəvi bağ əmələ gəlir. elektrovalent"(indi çağırılır ion).
Bu halda, anionlar və kationlar doldurulmuş xarici elektron qabığı olan sabit elektron konfiqurasiya təşkil edir. Tipik ion bağları dövri sistemin T və II qrup kationlarından və VI və VII qrupların qeyri-metal elementlərinin anionlarından (müvafiq olaraq 16 və 17 alt qrup) əmələ gəlir. xalkogenlər Və halogenlər). İon birləşmələrinin bağları doymamış və istiqamətsizdir, buna görə də digər ionlarla elektrostatik qarşılıqlı təsir imkanlarını saxlayırlar. Şəkildə. Şəkil 2 və 3-də elektron ötürülməsinin Kossel modelinə uyğun gələn ion bağlarının nümunələri göstərilir.
düyü. 2.
düyü. 3. Süfrə duzunun molekulunda ion bağı (NaCl)
Burada təbiətdəki maddələrin davranışını izah edən bəzi xassələri xatırlatmaq yerinə düşər, xüsusən də ideyanı nəzərdən keçirək turşular Və səbəblər.
Bütün bu maddələrin sulu məhlulları elektrolitlərdir. Rəngini fərqli dəyişirlər göstəricilər. Göstəricilərin təsir mexanizmini F.V. Ostwald. O göstərdi ki, göstəricilər zəif turşular və ya əsaslardır ki, onların rəngi dissosiasiya olunmamış və dissosiasiya olunmuş vəziyyətdə fərqlənir.
Əsaslar turşuları neytrallaşdıra bilər. Bütün əsaslar suda həll olunmur (məsələn, tərkibində OH qrupları olmayan bəzi üzvi birləşmələr həll olunmur, xüsusən, trietilamin N(C 2 H 5) 3); həll olunan əsaslar adlanır qələvilər.
Turşuların sulu məhlulları xarakterik reaksiyalara məruz qalır:
a) metal oksidləri ilə - duz və suyun əmələ gəlməsi ilə;
b) metallarla - duz və hidrogen əmələ gəlməsi ilə;
c) karbonatlarla - duz əmələ gəlməsi ilə, CO 2 və N 2 O.
Turşuların və əsasların xassələri bir neçə nəzəriyyə ilə təsvir edilmişdir. S.A.-nin nəzəriyyəsinə uyğun olaraq. Arrhenius, bir turşu ionları əmələ gətirmək üçün ayrılan bir maddədir N+ , əsas isə ionlar əmələ gətirir O- . Bu nəzəriyyə hidroksil qrupları olmayan üzvi əsasların mövcudluğunu nəzərə almır.
Uyğun olaraq proton Bronsted və Lowry nəzəriyyəsinə görə, turşu protonları verən molekullar və ya ionları ehtiva edən bir maddədir ( donorlar protonlar) və əsas protonları qəbul edən molekullardan və ya ionlardan ibarət bir maddədir ( qəbuledicilər protonlar). Qeyd edək ki, sulu məhlullarda hidrogen ionları hidratlanmış formada, yəni hidronium ionları şəklində mövcuddur. H3O+ . Bu nəzəriyyə təkcə su və hidroksid ionları ilə deyil, həm də həlledici olmadıqda və ya susuz həlledici ilə aparılan reaksiyaları təsvir edir.
Məsələn, ammonyak arasındakı reaksiyada N.H. 3 (zəif əsas) və hidrogen xlorid qaz fazasında bərk ammonium xlorid əmələ gəlir və iki maddənin tarazlıq qarışığında həmişə 4 hissəcik var, onlardan ikisi turşu, digər ikisi isə əsasdır:
Bu tarazlıq qarışığı iki birləşmiş turşu və əsas cütündən ibarətdir:
1)N.H. 4+ və N.H. 3
2) HCl Və Cl ‑
Burada hər bir konjugat cütlüyündə turşu və əsas bir protonla fərqlənir. Hər turşunun birləşmiş əsası var. Güclü turşunun zəif birləşmiş əsası, zəif turşunun isə güclü birləşmə əsası var.
Bronsted-Lowry nəzəriyyəsi suyun biosferin həyatı üçün unikal rolunu izah etməyə kömək edir. Su, onunla qarşılıqlı əlaqədə olan maddədən asılı olaraq, həm turşu, həm də əsas xüsusiyyətlərini nümayiş etdirə bilər. Məsələn, sirkə turşusunun sulu məhlulları ilə reaksiyalarda su əsas, ammonyakın sulu məhlulları ilə reaksiyalarda isə turşudur.
1) CH 3 COOH + H2O ↔ H3O + + CH 3 COO- . Burada sirkə turşusu molekulu su molekuluna proton verir;
2) NH 3 + H2O ↔ NH 4 + + O- . Burada ammonyak molekulu su molekulundan proton qəbul edir.
Beləliklə, su iki konjugat cüt yarada bilər:
1) H2O(turşu) və O- (birləşən əsas)
2) H 3 O+ (turşu) və H2O(birləşən əsas).
Birinci halda su bir proton verir, ikinci halda isə onu qəbul edir.
Bu əmlak adlanır amfiprotonizm. Həm turşu, həm də əsas kimi reaksiya verə bilən maddələr deyilir amfoterik. Bu cür maddələr canlı təbiətdə tez-tez olur. Məsələn, amin turşuları həm turşularla, həm də əsaslarla duzlar əmələ gətirə bilər. Beləliklə, peptidlər mövcud metal ionları ilə asanlıqla koordinasiya birləşmələri əmələ gətirirlər.
Beləliklə, ion bağının xarakterik xüsusiyyəti, bağlanan elektronların nüvələrdən birinə tam hərəkət etməsidir. Bu o deməkdir ki, ionlar arasında elektron sıxlığının demək olar ki, sıfır olduğu bir bölgə var.
İkinci növ əlaqəkovalent əlaqə
Atomlar elektronları paylaşaraq sabit elektron konfiqurasiyalar yarada bilər.
Belə bir əlaqə bir cüt elektronun bir-bir paylaşıldığı zaman yaranır hamıdan atom. Bu halda ortaq əlaqə elektronları atomlar arasında bərabər paylanır. Kovalent bağların nümunələri daxildir homonuklear diatomik molekullar H 2 , N 2 , F 2. Eyni növ əlaqə allotroplarda da olur O 2 və ozon O 3 və çox atomlu bir molekul üçün S 8 və həmçinin heteronuklear molekullar hidrogen xlorid HCl, karbon qazı CO 2, metan CH 4, etanol İLƏ 2 N 5 O, kükürd heksaflorid SF 6, asetilen İLƏ 2 N 2. Bütün bu molekullar eyni elektronları paylaşır və onların bağları doymuş və eyni şəkildə yönəldilmişdir (şək. 4).
Bioloqlar üçün ikiqat və üçlü bağların tək bir bağla müqayisədə kovalent atom radiusunu azaltması vacibdir.
düyü. 4. Cl 2 molekulunda kovalent bağ.
İon və kovalent bağ növləri bir çox mövcud kimyəvi bağ növlərinin iki ekstremal halıdır və praktikada əksər bağlar aralıqdır.
Dövri sistemin eyni və ya müxtəlif dövrlərinin əks uclarında yerləşən iki elementin birləşmələri əsasən ion bağları əmələ gətirir. Müəyyən müddət ərzində elementlər bir-birinə yaxınlaşdıqca onların birləşmələrinin ion xarakteri azalır, kovalent xarakteri isə artır. Məsələn, dövri cədvəlin sol tərəfindəki elementlərin halidləri və oksidləri əsasən ion bağları əmələ gətirir ( NaCl, AgBr, BaSO 4, CaCO 3, KNO 3, CaO, NaOH) və cədvəlin sağ tərəfindəki elementlərin eyni birləşmələri kovalentdir ( H 2 O, CO 2, NH 3, NO 2, CH 4, fenol C6H5OH, qlükoza C 6 H 12 O 6, etanol C 2 H 5 OH).
Kovalent bağ, öz növbəsində, daha bir modifikasiyaya malikdir.
Çox atomlu ionlarda və mürəkkəb bioloji molekullarda hər iki elektron yalnız ondan gələ bilər bir atom. Bu adlanır donor elektron cütü. Bu elektron cütünü bir donorla paylaşan bir atom deyilir qəbul edən elektron cütü. Bu tip kovalent bağ deyilir koordinasiya (donor-akseptor, və yadative) rabitə(şək. 5). Bu növ bağ biologiya və tibb üçün ən vacibdir, çünki maddələr mübadiləsi üçün ən vacib olan d elementlərinin kimyası əsasən koordinasiya bağları ilə təsvir olunur.
Şek. 5.
Bir qayda olaraq, kompleks birləşmədə metal atomu elektron cütünün qəbuledicisi kimi çıxış edir; əksinə, ion və kovalent rabitələrdə metal atomu elektron donordur.
Kovalent rabitənin mahiyyəti və onun müxtəlifliyi - koordinasiya əlaqəsi GN-nin təklif etdiyi başqa bir turşu və əsas nəzəriyyəsinin köməyi ilə aydınlaşdırıla bilər. Lyuis. O, Bronsted-Lowry nəzəriyyəsinə görə "turşu" və "əsas" terminlərinin semantik konsepsiyasını bir qədər genişləndirdi. Lyuisin nəzəriyyəsi kompleks ionların əmələ gəlməsinin xarakterini və maddələrin nukleofil əvəzetmə reaksiyalarında, yəni CS-nin əmələ gəlməsində iştirakını izah edir.
Lyuisə görə turşu əsasdan elektron cütünü qəbul edərək kovalent rabitə yarada bilən maddədir. Lyuis bazası tək elektron cütü olan və elektron verərək Lyuis turşusu ilə kovalent bağ əmələ gətirən maddədir.
Yəni, Lyuisin nəzəriyyəsi turşu-qələvi reaksiyalarının diapazonunu protonların ümumiyyətlə iştirak etmədiyi reaksiyalara da genişləndirir. Üstəlik, bu nəzəriyyəyə görə protonun özü də bir turşudur, çünki bir elektron cütünü qəbul edə bilir.
Ona görə də bu nəzəriyyəyə görə kationlar Lyuis turşuları, anionlar isə Lyuis əsaslarıdır. Məsələn, aşağıdakı reaksiyalar ola bilər:
Yuxarıda qeyd olundu ki, maddələrin ion və kovalentə bölünməsi nisbidir, çünki metal atomlarından akseptor atomlarına tam elektron ötürülməsi kovalent molekullarda baş vermir. İon rabitəsi olan birləşmələrdə hər bir ion əks işarəli ionların elektrik sahəsində olduğu üçün onlar qarşılıqlı qütbləşir, qabıqları deformasiyaya uğrayır.
Qütbləşmə qabiliyyəti ionun elektron quruluşu, yükü və ölçüsü ilə müəyyən edilir; anionlar üçün kationlardan daha yüksəkdir. Kationlar arasında ən yüksək qütbləşmə qabiliyyəti daha böyük yüklü və daha kiçik ölçülü kationlara aiddir, məsələn, Hg 2+, Cd 2+, Pb 2+, Al 3+, Tl 3+. Güclü qütbləşdirici təsirə malikdir N+ . İon qütbləşməsinin təsiri ikitərəfli olduğundan, onların əmələ gətirdiyi birləşmələrin xassələrini əhəmiyyətli dərəcədə dəyişir.
Üçüncü əlaqə növüdipol-dipol əlaqə
Sadalanan rabitə növləri ilə yanaşı, dipol-dipol da var molekullararası qarşılıqlı təsirlərə də deyilir van der Waals .
Bu qarşılıqlı təsirlərin gücü molekulların təbiətindən asılıdır.
Üç növ qarşılıqlı əlaqə var: daimi dipol - daimi dipol ( dipol-dipol cazibə); daimi dipol - induksiya edilmiş dipol ( induksiya cazibə); ani dipol - induksiya edilmiş dipol ( dağıtıcı cazibə və ya London qüvvələri; düyü. 6).
düyü. 6.
Yalnız qütb kovalent bağları olan molekullar dipol-dipol momentinə malikdir ( HCl, NH 3, SO 2, H 2 O, C 6 H 5 Cl) və bağlanma gücü 1-2-dir Debaya(1D = 3,338 × 10‑30 kulon metr - C × m).
Biokimyada başqa bir əlaqə növü var - hidrogen məhdudlaşdırıcı hal olan əlaqə dipol-dipol cazibə. Bu bağ hidrogen atomu ilə kiçik elektronmənfi atom, əksər hallarda oksigen, flüor və azot arasındakı cazibə nəticəsində əmələ gəlir. Bənzər elektronmənfiliyə malik olan böyük atomlarla (xlor və kükürd kimi) hidrogen bağı daha zəifdir. Hidrogen atomu bir əhəmiyyətli xüsusiyyəti ilə fərqlənir: bağlayıcı elektronlar çəkildikdə onun nüvəsi - proton ifşa olunur və artıq elektronlar tərəfindən qorunmur.
Beləliklə, atom böyük bir dipola çevrilir.
Van der Waals bağından fərqli olaraq hidrogen bağı təkcə molekullararası qarşılıqlı təsirlər zamanı deyil, həm də bir molekul daxilində əmələ gəlir. molekuldaxili hidrogen bağı. Hidrogen bağları biokimyada mühüm rol oynayır, məsələn, a-spiral şəklində zülalların strukturunu sabitləşdirmək və ya DNT-nin qoşa spiralının əmələ gəlməsi üçün (şək. 7).
Şəkil 7.
Hidrogen və van der Waals bağları ion, kovalent və koordinasiya bağlarından çox zəifdir. Molekullararası bağların enerjisi cədvəldə göstərilmişdir. 1.
Cədvəl 1. Molekullararası qüvvələrin enerjisi
Qeyd: Molekullararası qarşılıqlı təsirlərin dərəcəsi ərimə və buxarlanma (qaynama) entalpiyası ilə əks olunur. İon birləşmələri ionları ayırmaq üçün molekulları ayırmaqdan daha çox enerji tələb edir. İon birləşmələrinin ərimə entalpiyası molekulyar birləşmələrə nisbətən daha yüksəkdir.
Dördüncü əlaqə növümetal əlaqə
Nəhayət, molekullararası bağların başqa bir növü var - Metal: metal qəfəsin müsbət ionlarının sərbəst elektronlarla əlaqəsi. Bu tip əlaqə bioloji obyektlərdə baş vermir.
Bağ növlərinin qısa nəzərdən keçirilməsindən bir detal aydın olur: metal atomunun və ya ionunun - elektron donorunun, eləcə də atomun - elektron qəbuledicisinin vacib parametri onun ölçüsü.
Təfərrüatlara varmadan qeyd edirik ki, dövri sistemin qruplarında atom sayı artdıqca atomların kovalent radiusları, metalların ion radiusları və qarşılıqlı təsirdə olan molekulların Van der Vaals radiusları artır. Bu vəziyyətdə ion radiuslarının dəyərləri ən kiçik, van der Waals radiusları isə ən böyükdür. Bir qayda olaraq, qrupdan aşağıya doğru hərəkət edərkən, həm kovalent, həm də van der Waals olmaqla bütün elementlərin radiusları artır.
Bioloqlar və həkimlər üçün ən böyük əhəmiyyəti vardır koordinasiya(donor-akseptor) koordinasiya kimyası ilə nəzərdə tutulan bağlar.
Tibbi bioinorganika. G.K. Baraşkov